


Patrocinado por:

Prólogo
“En principio, la investigación necesita más cabezas que medios.”
Premio Nobel, Dr. Severo Ochoa de Albornoz
Prólogo
El término manual hace referencia a un libro en el que se compendia lo más sustancial de una materia. El manual que tienes ante ti surge como respuesta a las inquietudes que todo profesional de la salud en formación desarrolla a lo largo de su periplo discente, centrándose en el apasionante mundo de la investigación e innovación (I+i) en ciencias de la salud, que ineludiblemente han de formar parte del motor que nos ayude a ser mejores farmacéuticos de hospital. Es indudable que el binomio formado por la investigación y la innovación contribuye directamente a la prosperidad y al bienestar individual, y a la del colectivo en general, destacando sobremanera la contribución que el concepto salud genera en la sociedad actual y, en creciente importancia si cabe, en la sociedad futura.
Al hilo de estas premisas, una cuestión que nos podemos plantear es la siguiente: ¿los países ricos invierten en ciencia o los países que invierten en ciencia se vuelven ricos? La observación de la realidad demuestra que la inversión formativa en I+i genera retorno económico, empleo y un enorme abanico de beneficios para el colectivo ciudadano. Sirva esta analogía para poder afirmar que los profesionales de la salud que inviertan en formación en estos aspectos en concreto serán los mejor posicionados para afrontar los cambios que los sistemas de salud deban acometer en cada momento y, por lo tanto, los destinados a enriquecer y satisfacer con su aporte de valor las necesidades y expectativas que los pacientes y la sociedad de forma global tengan en su devenir.
En los últimos años el aumento de la competitividad de la ciencia ha ido acompañado de una mejora en el ecosistema de la investigación e innovación. Aunque, desafortunadamente, España invierte en I+i menos que la media de sus socios europeos y la distribución público-privada no es la más adecuada para aumentar el impacto del conocimiento en la economía y el bienestar (relacionado o no con la salud), creemos que el pilar de los recursos humanos, en este caso de los sistemas sanitarios (y de salud), puede y debe ser generador de un cambio radical a este respecto. En este contexto, y teniendo en cuenta el proceso de transformación digital, existe una gran necesidad de programas que potencien la I+i mediante el acompañamiento y el apoyo a la transferencia tecnológica con un impacto social claro y medible.
Desde la Dirección I+i de la Sociedad Española de Farmacia Hospitalaria (SEFH) pretendemos facilitar la adquisición de las mejores y más actuales competencias I+i para nuestros residentes en formación, integrando en la medida de lo posible las nuevas tecnologías. Estamos convencidos de que este manual brinda como mínimo esta posibilidad, así como la de disponer de puntos de referencia sencillos y prácticos, y, sobre todo, de una hoja de ruta para poder propiciar una investigación innovadora y de calidad.
Todo ello ha sido posible gracias al inestimable trabajo del elenco de autores que han desarrollado todos y cada uno de los capítulos de este manual. Queremos manifestar nuestra enorme gratitud por su dedicación y esfuerzo. A través de su experiencia, visión, reflexiones y distintos puntos de vista, estamos convencidos de que conseguirán servir de acicate al lector para desarrollar una mejor investigación, contribuir a la innovación abierta, siempre con fines muy prácticos, y orientada a conseguir los mejores resultados en salud.
[1] Identificación, formulación
y análisis de las preguntas
de investigación
1. Introducción
La formulación de la pregunta de investigación es el primer paso en el desarrollo de un proyecto de investigación.
Si la pregunta que definimos no es la adecuada, el resto del estudio tampoco lo será.
El reto no es formular la pregunta, sino encontrar una pregunta relevante que se pueda transformar a la vez en un plan de estudio válido y factible.
El principal motivo de rechazo de las comunicaciones científicas enviadas a congresos está relacionado precisamente con el error a la hora de definir la pregunta de investigación. Por esta razón, la identificación, la formulación y el análisis de la pregunta resultan un punto crítico en el proceso de investigación.
Díaz Portillo J, Orgaz Morales T, Roviralta Arango E. Guía metodológica de investigación en Ciencias de la Salud. Madrid: Instituto Nacional de Gestión Sanitaria; 2010.
[1] Identificación, formulación
y análisis de las preguntas
de investigación
2. Identificación de la pregunta de investigación
Las características que debe tener una pregunta de investigación son las incluidas en los criterios FINER.
Hulley SB, Cummings SR, Browner WS, Grady DG, Newman TB. Designing clinical research.
Philadelphia: Lippincott Williams & Wilkins; 2011.
Características de la pregunta de investigación
| Factible | Número adecuado de individuos |
| Experiencia técnica adecuada | |
| Abordable en cuanto a tiempo y dinero | |
| Manejable en cuanto a alcance | |
| Interesante para el investigador, novedosa | Confirma o refuta hallazgos previos |
| Amplía hallazgos previos | |
| Proporciona nuevos resultados | |
| Ética y relevante | Para el conocimiento científico |
| Para la política clínica sanitaria | |
| Para líneas de investigación futuras |
Ana de Lorenzo Pinto
Hospital General Universitario Gregorio Marañón, Madrid
La pregunta de investigación
[1] Identificación, formulación
y análisis de las preguntas
de investigación
3. Formulación y análisis de la pregunta de investigación
1. Revisar los conocimientos previos sobre el tema para depurar la pregunta que inicialmente hemos planteado y evitar la duplicidad de trabajos.
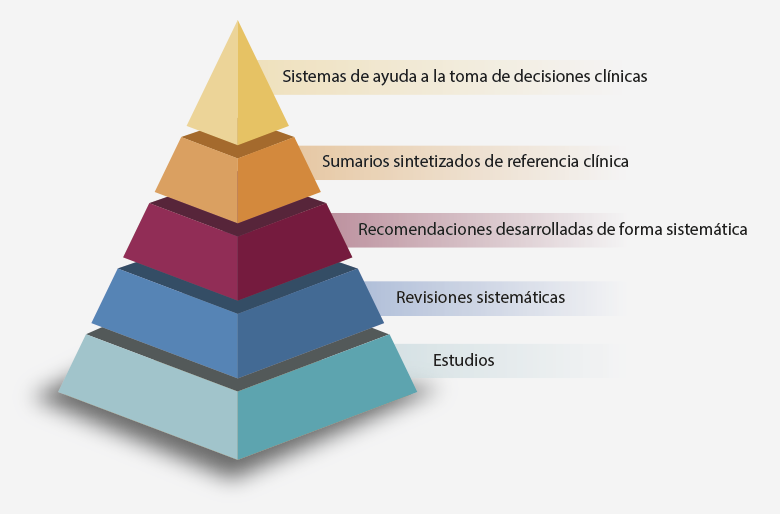
Conviene recordar la pirámide de la evidencia que estructura los recursos de información de acuerdo a su utilidad y propiedades en la toma de decisiones en la atención sanitaria.
2. Escribir la pregunta de investigación y un esbozo del plan de estudio de una o dos páginas de extensión.
3. Pensar con antelación las limitaciones que puede tener nuestro proyecto y el alcance de las mismas.
Farrugia P, Petrisor BA, Farrokhyar F, Bhandari M. Practical tips for surgical research: Research questions, hypotheses and objectives. Can J Surg. 2010;53(4):278-81.
Existen diferentes métodos empleados en la práctica clínica habitual que pueden ser de utilidad para formular la pregunta en los estudios inferenciales (experimentales). Entre estos métodos, cabe destacar el método PICO y el método sistemático de Bordage y Dawson.
El método PICO es similar al utilizado en la metodología de medicina basada en la evidencia y es aplicable a preguntas inferenciales o analíticas.
- El paciente (P) o el problema de interés
- La intervención (I) que se desea considerar
- La intervención con la que se va a comparar (C)
- El resultado que interesa valorar (O de outcome)
Aplicación del método PICO
| P | I | C | O |
| Definir población | Intervención | Comparación | Resultado esperado |
| Pacientes del servicio de urgencias en tratamiento con fármacos cuya dosificación depende del peso corporal | Medir el peso corporal con balanzas de pie si el paciente tiene movilidad o preguntárselo si está encamado | Seguir estimando el peso corporal de manera visual | ¿Se reducen los efectos secundarios de los fármacos? ¿Se obtiene mayor eficacia? ¿Se reduce la estancia hospitalaria? |
- Tully MP. Research: articulating questions, generating hypotheses, and choosing study designs. Can J Hosp Pharm. 2014;67(1):31-4.
- Bragge P. Asking good clinical research questions and choosing the right study design. Injury. 2010;41 Suppl 1:S3-6.
- Pérez Atanasio JM, Sandoval Rincón MB. ¿Cómo formular una buena pregunta de investigación?
- Estructura y redacción de la pregunta de investigación. Orthotips. 2015;11(2):74-8.
- Aslam S, Emmanuel P. Formulating a researchable question: A critical step for facilitating good clinical research. Indian J Sex Transm Dis. 2010;31(1):47-50.
- Navarro-Mateu F, Martín García-Sancho JC. Formulación de preguntas clínicas e introducción a la estrategia de búsqueda de información [monografía en Internet]. Murcia: Consejería de Sanidad de la Región de Murcia
Raquel García Sánchez
Hospital General Universitario Gregorio Marañón, Madrid
El método sistemático de Bordage y Dawson es un esquema que sistematiza el diseño de un estudio experimental.
MÉTODO SISTEMÁTICO DE BORDAGE Y DAWSON
1 ¿Cuál es el tema o idea de la investigación?
Como ya hemos comentado, dos de los desafíos iniciales en el diseño de un estudio es seleccionar un tema relevante y transformarlo en una pregunta investigable. Desarrollar la pregunta de investigación normalmente comienza con algunas ideas generales sobre el área en el que nos gustaría investigar. Estas ideas pueden surgir de tu trabajo diario, como hemos mencionado más arriba en el apartado de “Identificación de la pregunta de investigación”.
2 ¿Qué se ha realizado ya sobre el tema? Revisión de la bibliografía
Una vez elegido el tema de investigación, es necesario revisar la bibliografía existente sobre la materia para fundamentar y desarrollar la pregunta de investigación. Este análisis permitirá averiguar qué se conoce sobre el tema y disponer de un marco teórico-conceptual en el que encuadrar la pregunta de investigación. La búsqueda bibliográfica también ayuda a identificar controversias y lagunas en el conocimiento, así como a definir aspectos específicos del diseño del estudio (criterios de inclusión y exclusión, tamaño muestral, variables, método de recolección y medición de datos, etc.).
3 ¿Cuáles son los principales resultados (variable dependiente) del estudio en el que se estás interesado?
4 ¿En qué intervenciones (variable dependiente) estás interesado?
5 ¿Se busca una diferencia o una relación (asociación)?
6 ¿A qué grupo (población) deseas aplicar los resultados del estudio?
7 ¿Cuál es tu pregunta de investigación específica? (incluye los cuatro elementos)
Las preguntas 3 a 7 consideran los cuatro elementos básicos que hay que tener en cuenta para estructurar una pregunta de investigación:
- La variable dependiente: variable que se asume que puede predecirse (depende de) a partir de los valores de una o más variables independientes, predictoras o explicativas24. La variable dependiente es el foco de la actividad o proyecto. Es la circunstancia o el problema que debe ser afectado o cambiado.
- La variable independiente: variable que se asume que puede ser utilizada para predecir o explicar los valores de otra variable con la que se supone que tiene una relación de dependencia (variable dependiente). Es el factor causal que parece influir en el problema o problemas. Es precursora de la variable dependiente.
- La relación entre ambas variables.
- La población objeto del estudio.
Argimon Pallás JM, Jiménez Villa J. Métodos de investigación clínica y epidemiológica. Madrid: Elsevier España; 2013.
En el ejemplo descrito en el apartado del método PICO se pueden identificar con claridad los cuatro elementos:
¿En los pacientes que acuden al servicio de urgencias y que son tratados con fármacos cuya dosificación depende del peso corporal (población), medir el peso corporal con balanzas de pie si el paciente presenta movilidad o preguntar directamente el peso si el enfermo está encamado (intervención: primer nivel de la variable independiente) comparado con la estimación del peso corporal de manera visual (intervención: segundo nivel de la variable independiente) mejorará los resultados clínicos (resultado: variable dependiente)?
8 ¿Cuál es la respuesta esperada a tu pregunta? Hipótesis de investigación
Una pregunta correctamente formulada conducirá a formular la hipótesis de investigación. La hipótesis es una oración declarativa que predice los resultados de un estudio de investigación basado en el conocimiento científico existente y en los supuestos declarados. Es una predicción que responde a la pregunta de investigación.
Lipowski EE. Developing great research questions. Am J Health Syst Pharm. 2008;65(17):1667-70.
En el ejemplo anterior, la hipótesis podría ser:
“En los pacientes que acuden al servicio de urgencias y que son tratados con fármacos cuya dosificación depende del peso corporal, el cálculo del peso con métodos precisos en lugar de su estimación visual mejorará los resultados clínicos”.
9 ¿Por qué es importante la pregunta actualmente? Relevancia
Como hemos visto al principio del capítulo, una buena pregunta de investigación debe ser relevante para el conocimiento científico, la práctica clínica y la dirección de investigaciones futuras, así como cumplir el resto de los criterios FINER (factible, interesante, novedosa, ética, relevante).
[1] Identificación, formulación
y análisis de las preguntas
de investigación
4. Consejos sobre la elección de una pregunta de investigación
Los diez mandamientos para la elección de un proyecto de investigación según Kahn.
1. Prever los resultados antes de la ejecución del estudio.
2. Elegir un área según el interés del resultado.
3. Buscar un nicho libre con potencialidad de desarrollo.
4. Acudir a charlas y leer artículos sobre temas distintos del propio campo de interés.
5. Edificar sobre un tema.
6. Establecer un equilibrio entre los proyectos de bajo y alto riesgo, pero incluir siempre un proyecto de alto riesgo y de gran interés en la cartera.
7. Prepararse para continuar un proyecto con la profundidad que haga falta.
8. Distinguirse del mentor.
9. No dar por supuesto que la investigación clínica sobresaliente, y ni tan siquiera la investigación clínica notable, es más fácil que la investigación básica sobresaliente.
10. Centrarse, centrarse, centrarse.
Kahn CR. Picking a research problem. The critical decision. N Engl J Med. 1994;330:1530-3.
[1] Identificación, formulación
y análisis de las preguntas
de investigación
Test de autoevaluación
-
1. La base de una buena investigación es definir una buena pregunta. Las características que debe tener una buena pregunta de investigación podrían resumirse de la siguiente manera:
- Debe aportar algún conocimiento nuevo, ampliar conocimientos previos o confirmarlos/refutarlos
- Debe tener, necesariamente, naturaleza inferencial.
- Aspectos como la viabilidad, la originalidad y la ética no son relevantes en cuanto a la calidad de la pregunta
-
2. La pirámide de la evidencia estructura los recursos de información de acuerdo con su utilidad y propiedades en la toma de decisiones en la atención sanitaria. En la actualidad, la pirámide aceptada contiene cinco escalones, de los cuales el primero y el último son, respectivamente:
- Estudios originales y sistemas de ayuda a la toma de decisiones clínicas.
- Estudios originales y revisiones sistemáticas.
- Revisiones sistemáticas y recomendaciones desarrolladas de forma sistemática.
-
3. El método PICO, que ayuda a estructurar la pregunta requiere que se definan los siguientes elementos:
- La intervención que se va a evaluar, la intervención con la que se va a comparar y el resultado que interesa valorar.
- La intervención que se va a evaluar y la intervención con la que se va a comparar.
- El paciente, la intervención que se va a evaluar y la intervención con la que se va a comparar, y el resultado que interesa valorar.
-
4. El método sistemático de Bordage y Dawson es útil para:
- Estructurar, identificar, formular y analizar la pregunta de investigación.
- Formular preguntas inferenciales.
- Formular preguntas descriptivas.
-
5. Podemos extraer recomendaciones respecto a la pregunta de investigación de lo dicho por Kahn respecto a la elección de un proyecto de investigación, entre ellas:
- Al elegir entre investigación básica e investigación clínica tener presente que la última es más sencilla de llevar a cabo.
- Sea cual sea el resultado, el estudio vale la pena
- Estar preparado o prepararse para continuar con un proyecto de investigación con la profundidad que haga falta.
[2] Selección de las estrategias y metodologías de investigación óptimas
1. Introducción
El diseño de la investigación engloba el conjunto de estrategias y metodologías definidas previamente al desarrollo del estudio y que permitirán dar respuesta a las preguntas planteadas. Un diseño adecuado del estudio es fundamental para garantizar que la investigación clínica sea de calidad.
En este capítulo pretendemos explicar de una manera breve y sencilla los distintos tipos de estudios que existen para ser capaces de seleccionar el más apropiado según la información que se desee extraer de una investigación.
Criterios de clasificación de los tipos de estudio
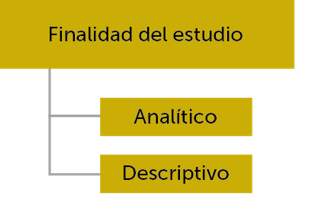
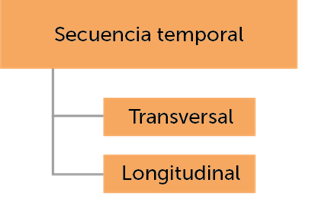
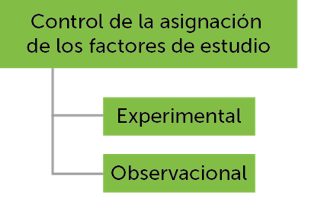
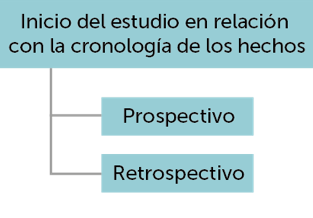
Identificación de los tipos de estudio
según la información que se desea extraer
[2] Selección de las estrategias y metodologías de investigación óptimas
2. Estudios observacionales
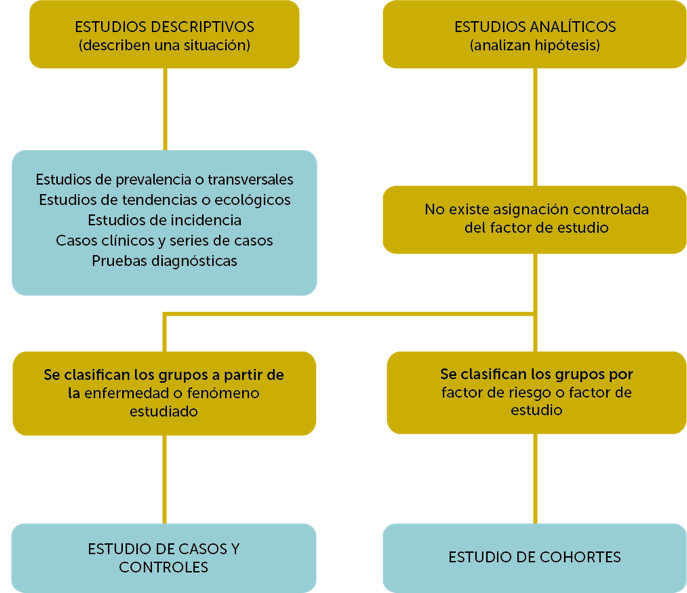
Los estudios observacionales son aquellos que se realizan para obtener información de la práctica clínica real. No se intenta intervenir, ni alterar el curso de la enfermedad. Los investigadores se limitan a observar el curso de la misma en los grupos con y/o sin las características a estudiar. Son menos concluyentes, pero aportan una información adicional y complementaria a la evidencia científica generada en los estudios experimentales.
Un estudio observacional puede ser descriptivo o analítico.
Características de los estudios descriptivos y analíticos
| Estudios descriptivos | Estudios analíticos |
| Estudian qué ocurre en una población | Estudian por qué ocurre y qué factores explican un problema. Relacionan variables |
¿Qué investigan?
|
¿Qué investigan?
|
| Determinan la frecuencia y distribución de la enfermedad en relación con la población, el lugar y el tiempo | Examinan la asociación causal de uno o varios factores con la enfermedad |
| Incluyen una sola población | Incluyen dos o más poblaciones |
| Proporcionan una primera visión para formular una hipótesis | Pretenden la validación de una hipótesis |
| Se llevan a cabo cuando se sabe poco sobre la historia natural o determinantes de la enfermedad | Son útiles cuando se sabe suficiente sobre una enfermedad para establecer una hipótesis |
Tipos de estudios observacionales.
Rocío Vázquez Sánchez
Hospital Universitario de Getafe. Madrid
Estudios observacionales
[2] Selección de las estrategias y metodologías de investigación óptimas
2.1. Estudios observacionales analíticos
Dentro de los estudios observacionales analíticos, los estudios de cohortes y de casos y controles constituyen dos diseños robustos de interés en nuestro ámbito para determinar, por ejemplo, efectos relacionados con la medicación. Por otro lado, estos estudios son complementarios de los ensayos clínicos aleatorizados y pueden soslayar algunas de sus limitaciones.
Gamble JM. An introduction to the fundamentals of cohort and case-control studies. Can J Hosp Pharm. 2014;67(5):366-72.
Aportación de los estudios de cohortes y de casos y controles sobre las limitaciones de los ensayos clínicos
| Limitación de los ensanyos clínicos tradicionales | Estudios de cohortes y de casos y controles |
| Protocolos estrictos poco representativos de la práctica habitual | Representan la práctica habitual |
| Exclusión de poblaciones clave (p. ej., ancianos, niños, etc.) | Pueden focalizarse en grupos especiales o poco representados |
| Tamaño muestral limitado | Pueden incluir un alto número de sujetos, especialmente cuando se usan fuentes de datos secundarias, y permiten estudiar hallazgos poco frecuentes |
| Corta duración | El seguimiento puede ser prolongado |
| Alto coste | Bajo coste |
[2] Selección de las estrategias y metodologías de investigación óptimas
2.1.1. Estudios de cohortes
Una cohorte se define como un grupo de individuos que comparte una experiencia o una característica. Los estudios de cohortes son diseños analíticos observacionales en los que dos grupos de sujetos, uno con el factor de riesgo (cohorte expuesta) y otro sin él (cohorte no expuesta), serán estudiados a lo largo del tiempo con la finalidad de observar la aparición del hecho de interés.
Estos estudios pueden ayudar a determinar factores de riesgo, causalidad y la incidencia de una enfermedad o condición en un grupo o población.
Sánchez Marín FJ, Molina Durán F, Consejería de Sanidad de Murcia. Metodología de la investigación y práctica clínica basada en la evidencia. Murcia: Consejería de Sanidad de Murcia; 2013
Javier Sánchez-Rubio Fernández
Hospital Universitario de Getafe. Madrid
Estudios de cohortes
Los estudios de cohortes se pueden clasificar en diversos tipos.
Posibles diseños de los estudios de cohortes
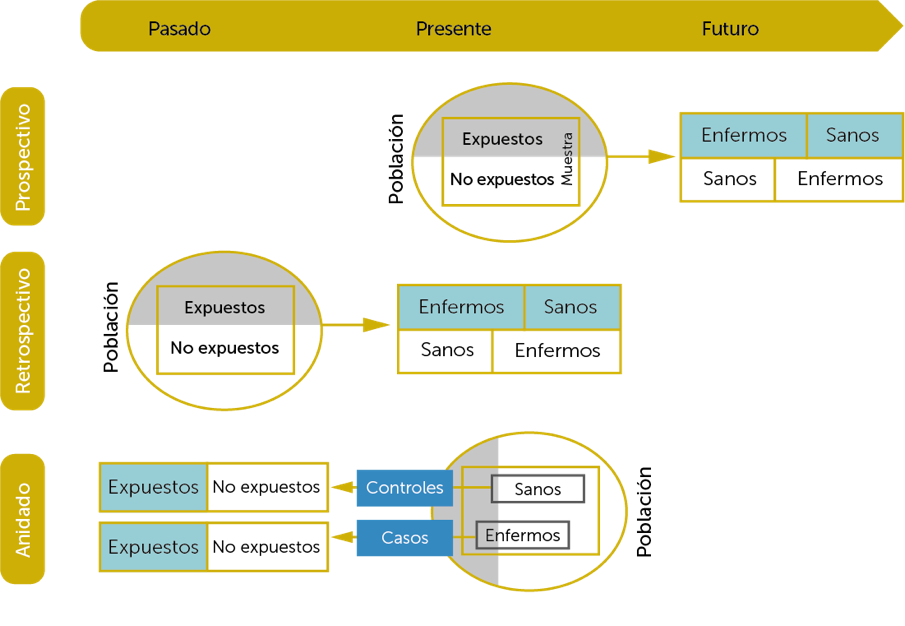
Hood MN. A review of cohort study design for cardiovascular nursing research. J Cardiovasc Nurs. 2009;24(6):E1-9.
Javier Sánchez-Rubio Fernández
Hospital Universitario de Getafe. Madrid
Diseños de los estudios de cohortes
[2] Selección de las estrategias y metodologías de investigación óptimas
3. Investigación cualitativa
La investigación cualitativa se ha incorporado desde hace varios años a las ciencias de la salud en una búsqueda de “contextualizar” a las personas estudiadas y valorar las necesidades y expectativas de salud desde la perspectiva de los individuos afectados.
Javier Sánchez-Rubio Fernández
Hospital Universitario de Getafe. Madrid
[2] Selección de las estrategias y metodologías de investigación óptimas
Test de autoevaluación
-
1. ¿Cuáles de las siguientes afirmaciones son ciertas con relación al diseño de la investigación?
- La definición de los objetivos del estudio y la hipótesis esté formulada son independientes de la elección del diseño de la investigación.
- El tipo de diseño de estudio es independiente de las características de este.
- El propósito final de todo diseño de investigación es minimizar el sesgo, evitar el efecto de posibles variables extrañas, y llegar a conclusiones válidas y fidedignas.
-
2. En los estudios observacionales, los investigadores no intervienen en los sucesos que tienen lugar en el estudio, simplemente observan:
- En los estudios observacionales descriptivos pueden realizarse comparaciones entre las variables.
- Los estudios observacionales descriptivos pueden ser de prevalencia, de tendencia, de incidencia y de series de casos.
- Los diferentes tipo de estudios observacionales descriptivos comparten fortalezas y limitaciones.
-
3. Los estudios observacionales analíticos, a diferencia de los descriptivos, analizan hipótesis:
- Por sus características, los estudios de cohortes y de casos y controles pueden complementar a los ensayos clínicos aleatorizados.
- Entre las limitaciones de los estudios de cohortes está la de evitar el sesgo de conocer con antelación el efecto.
- Entre las fortalezas de los estudios de casos y controles está la facilidad para establecer la secuencia temporal del factor o enfermedad.
-
4. En los estudios experimentales se realiza una intervención y se observa lo que ocurre. En el ámbito sanitario son especialmente relevantes los ensayos clínicos aleatorizados:
- Este tipo de estudio proporciona el más alto bajo de inferencia causal.
- En este tipo de estudio, a menudo se utiliza el enmascaramiento para reducir el sesgo; los estudios pueden ser simple, doble o triple ciego.
- Debido a la naturaleza de estos estudios no es necesario que un comité de ética los apruebe antes de llevarlos a cabo.
-
5. El objetivo de la investigación cualitativa es describir, explorar, entender y explicar fenómenos con métodos de investigación que incluyen datos no numéricos; por lo tanto, son útiles para estudiar aspectos de difícil cuantificación:
- Sin embargo, la investigación cualitativa no difiere metodológicamente de la cuantitativa en la recogida de datos ni en su posterior análisis.
- Pueden complementar a los métodos cuantitativos o ser una alternativa cuando estos no son factibles; por ello reciben el nombre de cuasiexperimentales.
- Una de las situaciones en que son útiles es para ayudar a definir la pregunta de investigación y generar la hipótesis.
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
1. Introducción: salud y factores determinantes
La incorporación a las guías de práctica clínica de los resultados en salud obtenidos en la vida real (fruto de la evaluación farmacoeconómica dinámica tras la incorporación de los medicamentos a la práctica asistencial), apoyada por un proceso transparente en el flujo de información, supondría una ayuda a la decisión terapéutica y contribuiría a mejorar la calidad asistencial.
Entre los diversos modelos de determinantes de la salud destaca el modelo holístico de Laframboise, que establece que la salud de un colectivo o de una población es el resultado de la interacción de un conjunto de factores o variables que pueden agruparse en cuatro categorías: la biología humana, el medio ambiente, los estilos de vida y el sistema de cuidados de salud.
Girón Daviña P. Los determinantes de la salud percibida en España. Madrid: Universidad Complutense de Madrid, 2010 [tesis doctoral].
Irene Zarra Ferro
Hospital Clínico Universitario Complexo Hospitalario de Santiago de Compostela
Salud y factores determinantes
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
2. Foco del sistema sanitario: calidad asistencial
Se entiende por calidad asistencial el grado en el que el proceso asistencial aumenta la probabilidad de obtener los resultados deseados por el paciente y reduce los no deseados, según el estado actual de los conocimientos médicos. Dicho de otra manera, se puede decir que consiste en disponer y organizar los elementos y recursos del sistema sanitario de tal manera que se logren los mejores resultados posibles en salud y en la calidad de vida de los pacientes y usuarios.
Los principales objetivos de la calidad asistencial son, prestar asistencia sanitaria acorde al estado de la ciencia y a las evidencias disponibles en ese momento, y conseguir una atención sanitaria que satisfaga al paciente asegurando la accesibilidad y continuidad de los cuidados.
Pedro D. En búsqueda de la triple meta: una invitación a la exploración conjunta. Vía Salud. 2012;16(1):4-11.
Irene Zarra Ferro
Hospital Clínico Universitario Complexo Hospitalario de Santiago de Compostela
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
3. Evidencia poblacional. ¿Guías de práctica clínica?
Una práctica asistencial de calidad requiere que las decisiones clínicas que tomen profesionales y pacientes estén basadas en el mejor conocimiento científico disponible. La medicina basada en la evidencia (MBE) promulga la superioridad de los ensayos clínicos controlados y aleatorizados, junto con las revisiones sistemáticas y metaanálisis, para la evaluación de la eficacia de las distintas intervenciones terapéuticas, y ha sido el principal mecanismo para transformar la base de la práctica médica, pasando de la experiencia individual de cada profesional a una base científica común para todo el colectivo sanitario.
Irene Zarra Ferro
Hospital Clínico Universitario Complexo Hospitalario de Santiago de Compostela
Las guías de práctica clínica son un conjunto de recomendaciones basadas en una revisión sistemática de la evidencia y en la evaluación de los riesgos y beneficios de las diferentes alternativas, con el objetivo de optimizar la atención sanitaria a los pacientes. Son necesarias para ordenar, evaluar y graduar el conocimiento disponible sobre una entidad clínica específica y con ello disminuir la variabilidad en la práctica clínica.
A pesar de los muchos y evidentes aspectos positivos de las guías, el grado de cumplimiento de sus recomendaciones es sorprendentemente bajo, y algunas de las razones de ello son:
- Complejidad del sistema sanitario y ausencia de conocimiento por parte del profesional.
- Contenido de las guías.
- Comportamiento y actitudes de los profesionales.
- Incorporación de necesidades e intereses de los pacientes.
- Arcelay A, Iruretagoyena ML, Reviriego E. Estudio sobre la utilización de las Guías de Práctica Clínica en Atención Especializada. Exploración de barreras y facilitadores para su implementación. Osakidetza y Osteba. Servicio de Evaluación de Tecnologías Sanitarias del País Vasco. Informe Osteba D-13-08. Vitoria-Gasteiz: Departamento de Salud, Gobierno Vasco; 2013.
- Martínez García L, Juliana Sanabria A, García Álvarez E, Trujillo-Martín MM, Etxeandia-Ikobaltzeta I, Kotzeva A, et al. The validity of recommendations from clinical guidelines: a survival analysis. CMAJ. 2014;186(16):1211-9.
- Ocharan-Corcuera J. La variabilidad en la práctica médica. Gac Med Bilbao. 2006;103:143. 12.
-Grupo de Trabajo sobre GPC. Elaboración de guías de práctica clínica en el Sistema Nacional de Salud. Manual metodológico. Madrid: Plan Nacional para el SNS del MSC; 2006.
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
4. Evaluación de resultados en salud
La disciplina de la medicina basada en la evidencia debería evolucionar de una manera lógica y natural hacia una medicina basada en resultados en salud, aunando los datos de eficacia y seguridad con otra información complementaria obtenida del comportamiento de los tratamientos una vez que empiezan a emplearse en condiciones de uso habitual.
Soto Álvarez J. Medicina basada en resultados en salud: la evolución lógica y deseable de la medicina basada en la evidencia. Med Clin. 2007;128:254-5.
Irene Zarra Ferro
Hospital Clínico Universitario Complexo Hospitalario de Santiago de Compostela
Evaluación de resultados en salud
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
5. Investigación con PRO (patient reported outcomes)
Los PRO se han definido como la información proporcionada directamente por el paciente en la valoración de su salud sin la interpretación de los profesionales.
Los estudios PRO tienen dos utilidades dependiendo del alcance: aplicados en la rutina diaria deben servir de soporte clínico para diseñar, evaluar y eventualmente modificar el plan terapéutico; y aplicados desde un ámbito más general por los sistemas de salud, sirven para evaluar el rendimiento de las organizaciones y de soporte a la decisión y distribución de recursos. La utilización rutinaria de los PRO tiene que cumplir algunas condiciones para ser factible:
- Tienen que ser parte de las herramientas de valoración de los pacientes, estar integrados en la historia clínica electrónica y no suponer una tarea más consumidora del escaso tiempo de los profesionales sanitarios.
- Tienen que demostrar impacto en mejorar la vida de las personas.
- Tienen que explotarse de manera que generen información útil y de forma ágil. El retorno a los profesionales debe ser rápido y comprensible para alimentar su motivación.
- Requieren de cierta madurez entre los protagonistas: desde los profesionales, que no deben considerar la subjetividad de estas herramientas como una debilidad y deben aceptarlas por su potencial beneficio, hasta los pacientes, que no deben ver los cuestionarios PRO como una dificultad de acceso o una intromisión excesiva en su intimidad.
Doward LC, McKenna SP. Defining patient-reported outcomes. Value Health. 2004;7 Suppl 1:S4.
La Agencia Europea del Medicamento (European Medicines Agency, EMA) publicó en 2016 un documento-guía sobre el uso de los PRO en los ensayos de medicamentos en oncología26. Las razones de incluirlos serían:
- Comprender cómo un tratamiento afecta el funcionamiento y el bienestar de los pacientes.
- Valorar la concordancia entre lo resultados clínicos obtenidos y los PRO.
- Considerar el beneficio clínico percibido por el paciente para completar los datos de eficacia y seguridad.
- En los ensayos de no inferioridad, diferenciar ambos medicamentos cuando se cumple la no inferioridad.
- Generar información que facilite la comunicación médico-paciente en términos de calidad del tiempo restante de supervivencia.
La recogida de los resultados en salud percibidos por el paciente se debe realizar a través de cuestionarios normalizados, de manera que sean analizables, medibles y comparables.
Committee for Medicinal Products for Human Use (CHMP). Appendix 2 to the Guideline on the evaluation of anticancer medicinal products in man EMA/CHMP/292464/2014. London: European Medicines Agency; 2016.
Cada instrumento o cuestionario puede medir cinco constructos o dominios de salud.
| Constructos o dominios de salud medidos por los cuestionarios |
| Constructo síntoma: es la percepción por parte del paciente de un estado anormal físico, emocional o cognitivo. Por ejemplo: “¿Tuvo dolor en alguna parte del cuerpo alguna vez en las últimas 4 semanas? Ninguno, muy poco, un poco, mucho, muchísimo” |
| Estado funcional: hace referencia a la capacidad del individuo para realizar sus actividades habituales |
| Percepción de salud: es una valoración subjetiva que comprende salud y estado funcional, del tipo: “Creo que me pongo enfermo más fácilmente que otras personas: totalmente cierta, bastante cierta, no lo sé, bastante falsa, totalmente falsa”. Ítem 36 del cuestionario de salud SF-36 (Short Form-36 Health Survey) |
| Calidad de vida relacionada con la salud |
| Satisfacción con el cuidado y resiliencia |
Las fuentes de instrumentos PRO más relevantes son:
- Iniciativa PROMIS (Patient-Reported Outcomes Measurement Information System).
- Iniciativa BiblioPRO.
- Iniciativa Piedra PROsetta.
Valderas JM, Ferrer M, Mendívil J, Garin O, Rajmil L, Herdman M, et al. Development of EMPRO: a tool for the standardized assessment of patient-reported outcome measures. Value Health. 2008;11(4):700-8.
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
6. Registros y big data
Analizar los resultados clínicos en la práctica real puede completar la evidencia generada por los ensayos clínicos, especialmente en aquellos casos de mayor incertidumbre por tratarse de subgrupos poco representados en los ensayos.
Llamamos big data a conjuntos de datos tan grandes que las aplicaciones informáticas tradicionales de procesamiento de datos no son suficientes para tratarlos (el capítulo 8 se dedica in extenso a este concepto). Las herramientas de big data permiten el análisis masivo de datos y encontrar patrones repetitivos dentro de los mismos.
La disponibilidad de tantos datos sobre la salud de las personas es provocadora, pero extraer información de esos datos es complicado. Esto crea desafíos para los métodos tradicionales multivariantes tales como el análisis de regresión de mínimos cuadrados ordinarios, puesto que muchas observaciones se pierden debido a la falta o continuidad de datos. El término machine learning se refiere a una gran familia de métodos matemáticos y estadísticos que históricamente se han centrado en la predicción.
- Alonso-Caballero J, Ferrer Fores M. Resultados reportados por los pacientes. Madrid: Ergon 2017.
- Aznar-Lou I, Fernández A, Gil-Girbau M, Sabés-Figuera R, Fajó-Pascual M, Peñarrubia-María MT, et al. Impact of initial medication non-adherence on use of healthcare services and sick leave: a longitudinal study in a large primary care cohort in Spain. Br J Gen Pract. 2017;67(662):e614-e622.
- Hastie T, Tibshirani R, Friedman J. The elements of statistical learning: Data mining, inference and prediction. New York: Springer Verlag; 2009.
- Alonso-Caballero J, Ferrer-Flores M. Resultados reportados por los pacientes (PROs). En: Monografías de Política y Gestión. Madrid: Fundación Gaspar Casal y Fundación Astra Zeneca; 2017.
[3] Investigación y evaluación
de resultados en salud
(datos de vida real)
Test de autoevaluación
-
1. En el ámbito sanitario, por “calidad asistencial” se entiende:
- La disposición y organización de los elementos y recursos del sistema sanitario de tal manera que se logren los mejores resultados en salud y en la calidad de vida de los pacientes y usuarios.
- Identificar los problemas con que se encuentra el personal sanitario.
- El grado en el que el proceso asistencial reduce el gasto público, pero obteniendo los resultados deseados por el paciente.
-
2. La información sobre la eficacia de las intervenciones sanitarias proporcionada por los ensayos clínicos controlados y aleatorizados es la base para que las agencias reguladoras aprueben o denieguen el uso de dicha intervención. Pero debe tenerse en cuenta que:
- Al extrapolar los resultados de los estudios controlados y aleatorizados a la práctica asistencial, cambian las condiciones de uso del fármaco (los pacientes son más heterogéneos y pueden recibir otras medicaciones concomitantemente, por ejemplo).
- Los estudios controlados y aleatorizados nos permiten conocer la eficacia de un fármaco en condiciones reales.
- Sin embargo, la diferencia entre eficacia y efectividad es fundamentalmente un concepto teórico y suele ser despreciable.
-
3. Las “Guías de práctica clínica” pretenden disminuir la variabilidad en la práctica médica en los sistemas sanitarios, con el objetivo de mejorar la calidad asistencial. Sin embargo, existe una baja adherencia a las recomendaciones de las guías de práctica clínica entre los profesionales sanitarios, lo que ocasiona una brecha entre evidencia científica y práctica médica:
- Se estima solo el 50% de la investigación inicial llega a producir beneficio en el paciente, en un tiempo promedio de 17 años.
- Para reducir dicha brecha, la medicina basada en la evidencia debería incorporar los conocimientos provenientes de estudios controlados y aleatorizados.
- La investigación de resultados en salud pretende cuantificar, analizar e interpretar los resultados en salud de las intervenciones sanitarias en condiciones de práctica médica habitual.
-
4. La investigación de resultados se centra en valorar distintos resultados en salud tras la aplicación de diferentes alternativas terapéuticas, con la finalidad de:
- Proporcionar una información de resultados que permita evaluar se determinados servicios sanitarios consiguen mantener o aumentar la salud de los individuos, con relación a la cantidad y la calidad de vida.
- Refutar o confirmar los resultados de los ensayos clínicos controlados y aleatorizados.
- Proporcionar argumentos económicos que permitan recortar el gasto sanitario.
-
5. El sistema sanitario ha evolucionado desde un modelo que ofrece lo que considera mejor desde una perspectiva tecnocrática a otro que propicia la participación de los ciudadanos en su diseño. Las medidas de los resultados en salud en este último modelo integran diferentes dimensiones:
- Calidad de vida, síntomas, satisfacción, bienestar general e impacto en la funcionalidad, informadas todas ellas por el paciente.
- Calidad de vida, síntomas, satisfacción, bienestar general e impacto en la funcionalidad, informadas todas ellas por el personal sanitario.
- Opinión del paciente sobre el personal sanitario.
[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
1. Introducción
Los datos referidos por los pacientes o patient report outcomes (PRO) serán, en los próximos años, elementos fundamentales para el cálculo del valor añadido o diferencial entre diferentes intervenciones o tecnologías sanitarias. La farmacia hospitalaria, por su cercanía al paciente, se revela como el referente profesional para su incorporación definitiva a la práctica asistencial y a la investigación basada en resultados en salud.
Ligado a la evolución de la farmacia hospitalaria a nivel mundial, el concepto y la importancia de los PRO han ido tomando cuerpo a partir de 2010. Por un lado, por la existencia de un número considerable de instrumentos de medida suficientemente válidos y robustos. Por otro, por la cada vez más insistente búsqueda y obtención de investigación centradas en los resultados de salud, así como el énfasis en los programas de mejoría de la calidad y los más recientes e incipientes programas para la mejora de la experiencia del paciente.
Aunque son múltiples las posibles aplicaciones y beneficios de los instrumentos PRO, es necesario superar una serie de barreras para su implantación definitiva como un elemento más en la aportación a la mejora de la gestión de los recursos, de todo tipo, en el ámbito sanitario.
Ramón Morillo Verdugo
Hospital Universitario de Valme. Sevilla
Concepto e importancia de los PRO
[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
2. El concepto
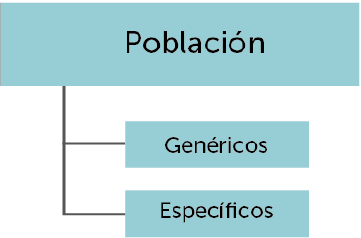
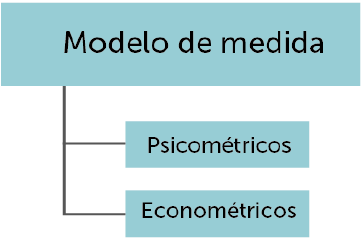
Los instrumentos PRO se pueden clasificar en cuatro grandes grupos de instrumentos de acuerdo a dos ejes: la población a la que se dirigen y el modelo de medida aplicado.
Clasificación de los instrumentos PRO según la población a la que se dirigen y el modelo de medida aplicado

[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
3. Fuentes
Existen diversas bases de datos especializadas, ya sean por enfermedades o por ámbitos de actuación médica o especialidades concretas.
Probablemente las bases de datos más importantes, por su contenido, detalle y gran cantidad de información e instrumentos disponibles, sean PROQOLID y BiblioPRO.
Bibliotecas, bases de datos o bancos de instrumentos
con información sobre PRO.
| Nombre (url) | Descripción |
| PROQOLID22 https://eprovide.mapi-trust.org/ |
Base de datos que recoge instrumentos PRO. Se actualiza de forma permanente con nuevos instrumentos basados en fuentes recomendadas como la FDA, la EMA y la comunidad científica. Se centra en incorporar nuevos instrumentos de evaluación de resultados clínicos, aportando su descripción. La metodología empleada y las propiedades psicométricas no se analizan |
| BiblioPRO23 https://www.bibliopro.org/ |
Biblioteca virtual de referencia científica internacional de los cuestionarios en español de PRO. Facilita cuestionarios identificados mediante revisión sistemática, los agrupa en una nueva taxonomía y aporta información amplia sobre el cuestionario y su calidad científica, evaluando las propiedades métricas |
| Health And Psychosocial Instruments (HAPI)24 http://bmdshapi.com/ |
Base de datos bibliográfica accesible con suscripción que contiene un amplio registro de instrumentos y herramientas de medida de diversas disciplinas de ciencias sociales y de la salud |
| Department of Health and Human Services Measure Inventory25 https://www.qualitymeasures.ahrq.gov/ |
Repositorio de medidas utilizadas por las agencias del Departamento de Salud y Servicios Sociales de Estados Unidos para medir, mejorar e informar sobre calidad |
| Health Services and Sciences Research Resources (HSRR)26 https://wwwcf.nlm.nih.gov/hsrr_search/ |
Base de datos diseñada para localizar recursos de ciencias sociales y salud pública del área sanitaria. Los usuarios pueden acceder a información de las herramientas como el conjunto de datos, el instrumento o índice de medida y recursos adicionales |
| Database of Instrument for Resource Use Measurement (DIRUM)27 http://www.dirum.org/ |
Base de datos de acceso abierto de recursos y cuestionarios para utilizar en evaluaciones económic |
| Rand Health28 https://www.rand.org/health/surveys_tools.html |
Dispone de instrumentos de acceso gratuito. Entre ellos se encuentran algunos muy empleados y traducidos a varios idiomas como el PSQ o el KDQOL |
| PsycTESTS via APA PsycNET29 https://www.apa.org/pubs/databases/psyctests/ |
Base de datos con una amplia colección de instrumentos utilizados por profesionales de las ciencias sociales y de la conducta. Información completa con resúmenes, textos completos y bibliografía |
| EULAR30 https://www.eular.org/ |
Instrumentos PRO validados en el campo de la reumatología |
- PROQOLID. Mapi Research Trust [Internet]. Mapi Research Trust: Quartier Lagardi; 2017.
- BiblioPRO [Internet]. Barcelona: Grupo de investigación en Servicios Sanitarios del IMIM-Hospital del Mar, con el apoyo de la Fundación IMIM.
- Health and Psychosocial Instruments (HAPI). Pittsburgh: Behavioral Measurement Database Services. 2015.
- National Quality Measures Clearinghouse [Internet]. Rockville, MD: Department of Health and Human Services Measure Inventory, Agency for Healthcare Research and Quality. 2017.
- Health Services and Sciences Research Resources [Internet]. Bethesda U.S. National Library of Medicine. 2017.
- Database of Instrument for Resource Use Measurement [Internet]. Bangor, UK: Medical Research Council Network of Hubs for Trial Methodology Research.
- Surveys [Internet]. Santa Monica, California: Survey Research Group, Rand Health. 2017.
- PsycTESTS [Internet]. Washington: American Psychological Association PsycNET. 2017
- Database of Instrument for Resource Use Measurement [Internet]. Kilchberg, Zürich: EULAR. 2017
[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
4. Evaluación
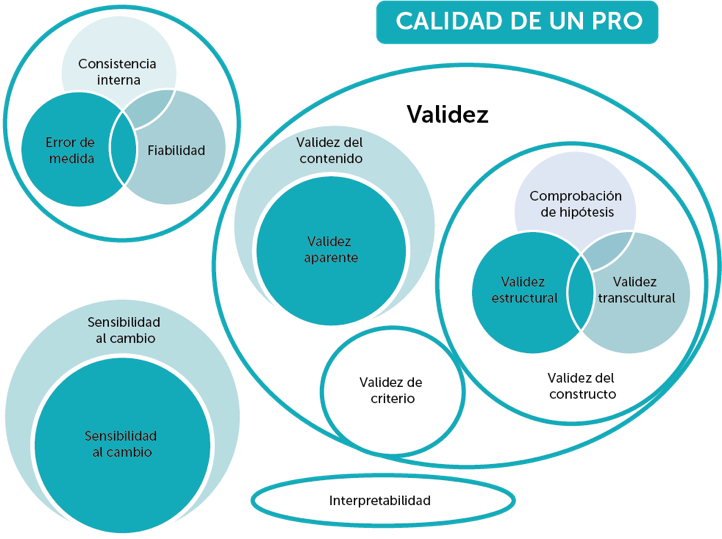
Para ser útiles en la investigación o en la práctica clínica, todos los instrumentos PRO deben cumplir unos mínimos estándares de calidad. Actualmente, existen dos herramientas estandarizadas bien establecidas: COnsensus-based Standards for the selection of health status Measurement INstruments (COSMIN) y Evaluating the Measurement of Patient-Reported Outcomes (EMPRO).
COSMIN
La pretensión de Cosmin es que la lista de comprobación y otros recursos sean útiles para comparar instrumentos PRO y facilitar su selección.
María de las Aguas Robustillo Cortés
Hospital Universitario de Valme. Sevilla
EMPRO
EMPRO permite una evaluación estandarizada, mediante consenso de expertos, de cada instrumento a través de la evidencia científica disponible.
EMPRO está basado en una exhaustiva lista de 39 criterios acerca de los ocho
atributos ideales que deberían cumplir los instrumentos PRO según las directrices
del comité científico del Medical Outcomes Trust.
Aaronson N, Alonso J, Burnam A, Lohr KN, Patrick DL, Perrin E, et al. Assessing health status and quality-of-life instruments: attributes and review criteria. Qual Life Res. 2002;11:193-205.
8 atributos ideales que deberían cumplir los instrumentos PRO
“Modelo conceptual y de medición”
(7 criterios), que evalúa cómo se han obtenido los conceptos a medir y hasta qué punto ha participado la población a la que va dirigido el instrumento.
“Fiabilidad”
(8 criterios), que considera hasta qué punto el instrumento está libre de error aleatorio, tanto si se ha evaluado la consistencia interna como la reproducibilidad test-retest.
“Validez”
(6 criterios), que considera hasta qué punto el instrumento mide aquello que pretende medir incluyendo la validez de contenido, de constructo y de criterio.
“Sensibilidad al cambio”
(3 criterios), que evalúa la capacidad de detectar cambios en el tiempo.
“Estrategias para la interpretación”
(3 criterios), que evalúa las estrategias propuestas para asignar sentido a las puntuaciones del instrumento.
“Carga de administración”
(7 criterios), que considera el tiempo, el esfuerzo y otras demandas requeridas tanto para administrar como para responder el instrumento.
“Modos de administración alternativos”
(2 criterios), que evalúa la equivalencia entre los modos de administración propuestos para el instrumento, tales como autoadministrado, administrado por entrevista cara a cara, entrevista telefónica o asistida por ordenador.
"Adaptaciones culturales o lingüísticas”
(3 criterios), que evalúa el proceso de adaptación seguido para conseguir la equivalencia de las versiones adaptadas.
[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
5. Recomendaciones para el uso e implantación de
los instrumentos PRO
1. Evaluación coste-efectividad
2. Atención farmacéutica
3. Gestión sanitaria
4. Investigación
5. De los PRO a los PREM
Alonso-Caballero J, Ferrer Fores M. Resultados reportados por los pacientes. Madrid: Ergon 2017.








De los PRO a los PREM
Los PREM representan otro elemento imprescindible en el ámbito sanitario y la investigación centrada en los pacientes, que ha sido poco trabajado desde el punto de vista de la farmacia hospitalaria.
[4] Utilización de datos
referidos por
los pacientes, un reto para
la investigación sanitaria
Test de autoevaluación
-
1. El desarrollo de instrumentos de medición de los PRO (datos referidos por los pacientes) se inició en 1948, pero su verdadera expansión tuvo lugar durante los noventa:
- Y, aunque su utilidad siempre ha sido puesta en tela de juicio, la aparición de nuevos instrumentos PRO se ha duplicado desde entonces.
- Dicha expansión se debió principalmente a la creciente importancia y valoración sobre el mantenimiento y la mejora del funcionamiento y el bienestar del paciente como objetivo prioritario de la atención sanitaria.
- Lamentablemente, existen pocos instrumentos PRO en español disponibles para su uso en nuestro ámbito.
-
2. ¿Cómo podemos conseguir el mayor impacto de la utilización de instrumentos PRO en farmacia hospitalaria?:
- Excluyendo los costes como indicador de resultados, puesto que la gestión sanitaria no es relevante en nuestro ámbito.
- Facilitando la validación en español de alguno de los instrumentos disponibles.
- Utilizándolos en la investigación, de acuerdo con las guías disponibles (CONSORT y FDA).
-
3. Los instrumentos PRO son un elemento de ayuda para la atención centrada en el paciente:
- A pesar de que la información que proporcionan no es rigurosa.
- En el futuro pueden llegar a sustituir al arsenal de información clínica y parámetros biológicos.
- Complementan el arsenal de información clínica y parámetros biológicos.
-
4. Los instrumentos PREM (medidas de las experiencias reportadas por el paciente) miden aspectos relevantes de la calidad percibida de los procesos de atención sanitaria y complementan a los PRO:
- Pero ya han sido demasiado utilizados desde la perspectiva de la farmacia hospitalaria, sin aportaciones que les otorguen valor.
- Recogen la experiencia sobre la atención, los tratamientos y el soporte recibido.
- Pero sus puntuaciones son dependientes de la salud percibida.
-
5. Los PRO constituyen una opción fundamental en la investigación comparativa de la efectividad, además:
- A pesar de haberse estancado en su evolución, siguen teniendo utilidad.
- No tienen gran potencial para influir en la realidad diaria de los servicio sanitarios.
- Añaden valor a la atención clínica individual, mejorando la calidad de los procesos, el benchmarking y la comparación de los proveedores de salud, así como los sistemas de información de salud poblacional.
[5] Sesgos en las
observaciones clínicas
1. Introducción
Uno de los mayores problemas en investigación es la ocurrencia de errores, que pueden darse de forma aleatoria o sistemática. Existe sesgo cuando se comete un error de forma sistemática, por causas relativas al propio observador, al fenómeno observado o a aquello con lo que se observa.
Cuando medimos sustancias fisiológicas o fármacos en una persona (orina, suero, sangre, etc.), estamos cometiendo un posible error, tanto en el procedimiento analítico utilizado como en la propia medición.
Todo ello se puede incluso complicar si se desea conocer la calidad de vida relacionada con la salud de los pacientes, ya que se debe definir claramente cómo se realiza la medida, a quiénes, cuándo y por qué, quién lo realiza y cómo se realiza, entre otras cuestiones.
Díez Vegas FJ. Probabilidad y teoría de la decisión en medicina. Programa modular Herramientas de gestión e investigación sanitaria. Madrid: UNED; 2005.
Piedad López Sánchez
Hospital General de Tomelloso, Ciudad Real
Los errores sistemáticos
La medición de las observaciones clínicas está sujeta a muchos y múltiples errores, que además son de naturaleza muy dispar. Por ello, pretendemos orientar a los farmacéuticos de hospital en formación sobre cómo realizar medidas exentas de sesgos y permitirles ser los agentes sanitarios que avalen, con su contribución profesional, las medidas que se registran tanto en investigación como en la asistencia sanitaria de los equipos multidisciplinares que atienden a los pacientes. En definitiva, que sean garantes de la calidad del registro de los datos y su gestión posterior, para llegar a resultados fiables y válidos que nos acerquen más a la verdad.
Francisco Javier Carrera Hueso
Hospital Dr. Moliner, Valencia
La calidad de los datos
[5] Sesgos en las
observaciones clínicas
2. Sesgos
Se define sesgo, o error sistemático, como cualquier error diferencial, en relación con los grupos que se comparan, en que se puede incurrir durante el diseño, conducción o análisis del estudio y que invariablemente resulta en una conclusión errónea, ya sea por una estimación más alta o más baja del valor real.
Los sesgos se pueden clasificar según la frecuencia en que se presentan y la etapa del estudio en que se originan, es decir, el sesgo en las observaciones clínicas, que se puede clasificar en tres categorías: sesgo de selección, sesgo de información y sesgo de confusión.
- Hernández-Ávila M, Garrido F, Salazar-Martínez E. Sesgos en estudios ideológicos. Salud Pública de México. 2000;42(5).
- Manterola C, Otzen T. Los sesgos en investigación clínica. Int J Morphol. 2015;33(3):1156-64.
Tipos de sesgos más comunes en estudios observacionales
| Posibilidad de | Cohoretes | Casos y controles | Corte transversal | Estudios ecológicos |
| Sesgo de selección | Baja | Alta | Media | No aplica |
| Sesgo de memoria | Baja | Alta | Alta | No aplica |
| Sesgo de confusión | Baja | Media | Media | Alta |
| Pérdidas de seguimiento | Alta | Baja | No aplica | No aplica |
| Tiempo necesario | Elevada | Media | Media | Baja |
| Coste | Alta | Media | Media | Baja |
Durante el curso de una investigación los sesgos pueden clasificarse también en función de la etapa del estudio en la que ocurren: sesgos en la etapa de planificación, sesgos en la etapa de muestreo y seguimiento, o sesgos en la etapa final del estudio, que se encuentran relacionados con la medición, el análisis, la interpretación y su comunicación.
Manterola C, Otzen T. Los sesgos en investigación clínica. Int J Morphol. 2015;33(3):1156-64.
Momentos de ocurrencia de sesgos en las distintas etapas de la investigación y estrategias para evitarlos
| Etapa del estudio | Estrategias para evitarlos |
| Planificación |
|
| Comienzo |
|
| Desarrollo |
|
| Finalización |
|
[5] Sesgos en las
observaciones clínicas
3. Criterios de causalidad
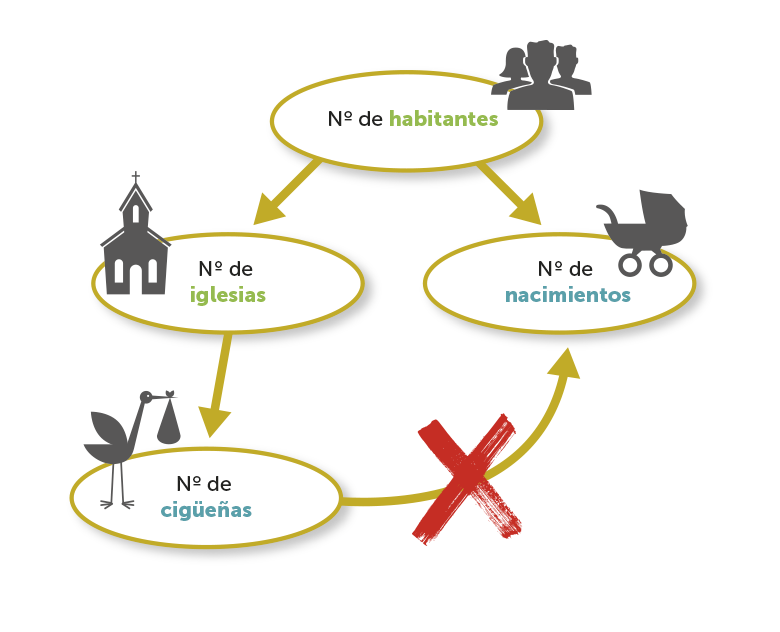
La causalidad implica correlación entre variables, pero la correlación no implica causalidad, conceptos muy distintos y que no debemos olvidar a la hora de analizar un estudio epidemiológico.
Los principales criterios para conocer la causalidad de un efecto fueron definidos por Hill en 1965. Con el tiempo se han ido añadiendo más, e incluso se siguen discutiendo.
Criterios de causalidad
Fuerza de asociación medida por la magnitud del riesgo relativo (RR ≠ 1).
Cuanto mayor es la fuerza de la asociación, más probable es que esta refleje una verdadera relación de causalidad, de modo que los posibles sesgos pueden haber influido sobre la cuantía de la asociación, pero es menos probable que hayan influido sobre su dirección.
Consistencia de la asociación en distintas personas, lugares, circunstancias, etc.
Aquí desempeña un papel esencial el análisis estratificado de nuestro estudio y de otros anteriores. Cuando se desea confirmar una hipótesis, se debería dar prioridad a los resultados similares obtenidos en estudios de diseño diferente.
Especificidad entre una causa y un efecto: relación biunívoca exclusiva.
Aunque no siempre es así, ya que, por ejemplo, el hábito tabáquico puede ser causante no solo del cáncer de pulmón sino de otros tumores, o de bronconeumonía obstructiva crónica y cardiopatía isquémica.
Precedencia temporal de la causa, es decir, que la causa preceda al efecto.
Aunque este criterio parezca obvio, no siempre lo es, sobre todo cuando se estudian enfermedades crónicas.
Gradiente biológico o gradiente dosis-respuesta.
Aquí es donde intervendrían los factores de confusión que lo suelen incumplir. La frecuencia o la gravedad de la enfermedad en estudio debe guardar relación con la dosis o con la duración de la exposición al factor de riesgo considerado. Aunque para la mayoría de las relaciones de causalidad esta consideración puede ser válida, hay que recordar que la frecuencia o la intensidad de algunos efectos (por ejemplo, reacciones de hipersensibilidad alérgica) no guardan relación con la dosis administrada.
Plausibilidad biológica de la relación.
Hace referencia a la concordancia de la asociación encontrada con los conocimientos biológicos y clínicos sobre la exposición de interés. No obstante, este es un criterio de importancia relativa, porque lo biológicamente plausible depende de los conocimientos biológicos que se tienen en cada momento sobre un problema determinado.
Coherencia o no conflictividad con los hechos asumidos de la historia natural y de la biología de la enfermedad en el momento presente.
Evidencia experimental o disminución-desaparición del efecto cuando se suprime la causa.
Este criterio es éticamente aplicable cuando un primer estudio observacional ha sugerido que una determinada intervención es preventiva o curativa.
Analogía o juicio de una relación por similitud con otras.
En ciertas circunstancias se pueden identificar asociaciones causales de naturaleza similar que pueden ayudar a establecer una relación de causalidad en el caso presente. Así, por ejemplo, si la talidomida produce graves malformaciones congénitas, es más fácil aceptar que otros fármacos también las puedan producir.
Probabilidad.
Hace referencia a la significación estadística.
Cumplimiento de las predicciones.
Consiste en demostrar que los hechos derivados de la asociación se producen en la realidad.
Ser comprobable.
[5] Sesgos en las
observaciones clínicas
4. Confusión
La confusión es la intromisión de una o más variables entre una exposición o causa y su desenlace o efecto, lo que provoca que el efecto de la causa se confunda con el agente que se quiere estudiar. Por tanto, una variable o factor de confusión se puede definir como la que distorsiona la medida de asociación entre otras dos variables.
De Irala J. Unidad 12: Validez y fiabilidad de las mediciones: sesgos, confusión, interacción. Diploma Superior en Metodología de la Investigación 2ª edición. Madrid: OMC-ISCIII; 2008.
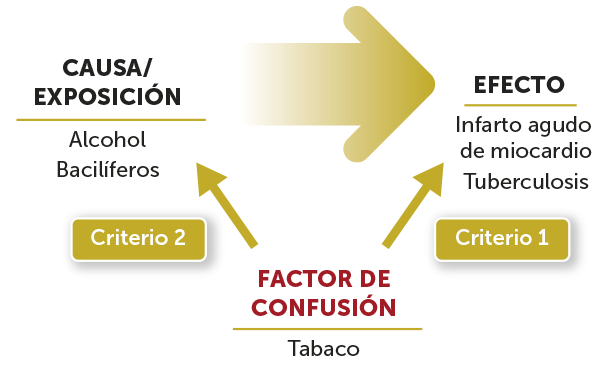
El fenómeno o sesgo de la confusión, a diferencia del resto de sesgos, es el resultado de relaciones específicas entre variables consideradas en un determinado estudio que no tiene por qué ser el resultado de errores cometidos por parte del investigador o de problemas en la valoración de los participantes o pacientes (revísense los apartados de sesgos de selección y de información).
Infarto de miocardio asociado al consumo moderado de alcohol por grupos de tabaquismo
| Infarto agudo de miocardio | Casos | Personas año | Tasa (por 1.000) | IR | ||
| Global | Consumo moderado de alcohol | Sí | 187 | 39.600 | 4,7 | 2,2 |
| No | 42 | 20.400 | 2,1 | |||
| Fumadores | Consumo moderado de alcohol | Sí | 173 | 21.600 | 8 | 0,8 |
| No | 24 | 2.400 | 10 | |||
| No fumadores | Consumo moderado de alcohol | Sí | 14 | 18.800 | 0,8 | 0,8 |
| No | 18 | 18.000 | 1 | |||
| Comprobación del criterio 1 (factor de confusión con efecto) | ||||||
| Beben alcohol | Fumadores | Sí | 173 | 21.600 | 8 | 10 |
| No | 14 | 18.000 | 0,8 | |||
| No beben alcohol | Fumadores | Sí | 24 | 2.400 | 10 | 10 |
| No | 18 | 18.000 | 1 | |||
| Comprobación del criterio 2 (factor de confusión con causa o exposición) | ||||||
| Fumadores | No fumadores | |||||
| Consumo moderado de alcohol | 21.600 (90%) | 18.000 (50%) | ||||
| No beben | 2.400 (10%) | 18.000 (50%) | ||||
| Total | 24.000 (100%) | 36.000 (100%) | ||||
IR=Razón de tasas
De Irala J. Unidad 12: Validez y fiabilidad de las mediciones: sesgos, confusión, interacción. Diploma Superior en Metodología de la Investigación 2ª edición. Madrid: OMC-ISCIII; 2008.
[5] Sesgos en las
observaciones clínicas
5. Aplicaciones prácticas
A continuación proponemos unos consejos prácticos a la hora de estudiar o analizar los datos de una investigación clínica de cara a minimizar el impacto de los sesgos.
- Establecer una hipótesis del estudio y la relación entre variables y definir claramente el objetivo del estudio, utilizando una pregunta que dé respuesta al formato PICO (patients, intervention, comparator y outcomes).
- Establecer el tipo de diseño que utilizaremos para contestar el objetivo de nuestro estudio (estudios de casos y controles, de cohortes, transversales, etc.).
- Realizar un protocolo para la correcta recogida de datos, definiendo cada una de las variables.
- Siempre es importante definir de manera operativa la recogida de datos, es decir, quién la realiza, en qué momento, por qué, etc.
- La base de datos utilizada para almacenar los datos recogidos puede ser de diferentes características pero siempre debemos realizarla de la manera más segura posible, exenta de errores.
- Describir con antelación los estadísticos que se utilizarán para cada uno de los objetivos propuestos inicialmente.
- Antes de proceder al análisis de datos, una vez disponemos de toda la información en nuestra base de datos, es obligado realizar una depuración de los mismos que nos ayude a cumplimentar los faltantes y los que se introdujeron de manera errónea.
[5] Sesgos en las
observaciones clínicas
Test de autoevaluación
-
1. La medición en las observaciones clínicas está sujeta a muchos posibles errores, aleatorios o sistemáticos
- Un error aleatorio es constante en cada medición y ocurre siempre en la misma dirección.
- Una medición tiene fiabilidad si mide realmente lo que se quiere medir.
- Una medición tiene validez si mide realmente lo que se quiere medir.
-
2. Se puede incurrir en sesgo durante el diseño, la realización o el análisis del estudio, lo que conduce a una conclusión errónea. Los sesgos en los estudios observacionales pueden ocurrir:
- Durante las diferentes etapas del estudio: en la planificación, durante el muestreo y seguimiento, o en la etapa final (medición, análisis e interpretación de los datos, etc.).
- Principalmente durante la medición, cuando un error al medir la exposición o la evolución genera información diferente entre los grupos que se comparan.
- Durante el análisis de los datos, por no elegir las pruebas estadísticas correctas.
-
3. ¿Son correctos los siguiente enunciados?:
- A la hora de analizar un estudio epidemiológico, es importante tener presente que la causalidad implica correlación, pero la correlación no implica causalidad.
- El resultado de la presencia de un factor de confusión se traduce siempre en un “sesgo positivo”: la observación de un efecto que no existe en realidad o la exageración de una asociación que sí existe.
- Un factor de riesgo, o pronóstico, de una enfermedad es toda variable que aumenta la probabilidad de que se presente la enfermedad; puede ser de dos tipos: explicativo o predictivo.
-
4. Los criterios de causalidad admitidos en la actualidad son los siguientes:
- Cuanto menor es la magnitud de la asociación, más probable es que esta refleje una verdadera relación; la asociación es consistente en distintas personas, lugares, circunstancias, etc.; la relación entre causa y efecto debe ser biunívoca exclusiva (aunque esto no siempre sucede así); la causa debe preceder temporalmente al efecto.
- La frecuencia o gravedad de la enfermedad estudiada debe estar relacionada con la dosis o el tiempo de exposición al factor de riesgo considerado (aunque a esto hay excepciones); debe haber coherencia con el conocimiento actual de la enfermedad; hay evidencia de la disminución-desaparición del efecto cuando se suprime la causa; asociaciones causales de naturaleza similar pueden ayudar a establecer una relación de causalidad; la relación observada debe tener significación estadística; en función de la asociación observada se pueden predecir eventos en la realidad; la relación observada es comprobable.
- El único de los criterios enumerados en los puntos a y b que es esencial para definir una relación causal es la significación estadística.
-
5. Cuando existe interdependencia entre los mecanismos de acción de dos o más factores causales para causar, prevenir o controlar una enfermedad, se dice que hay interacción (biológica, en este caso) entre ellos. La interacción (o modificación del efecto):
- Al igual que con la confusión, el fenómeno de la interacción debe controlarse, para evitar un sesgo en los datos.
- Puede ser sinérgica, cuando es necesario que concurran más de dos variables para que se produzca el efecto.
- Puede ser sinérgica, cuando el efecto de una variable neutraliza o cancela el de la otra.
[6] Legislación y bioética aplicadas
al campo de la investigación
e innovación clínica
1. Introducción
La investigación en sanidad, innovadora por definición y motivada por la permanente búsqueda de diagnósticos y terapias cada vez más seguros y eficaces, menos invasivos y menos dolorosos, en ocasiones puede plantear conflictos morales. Este capítulo trata sobre ética biomédica, y desde esta perspectiva reflexiona sobre aspectos del método científico y del desarrollo de los estudios de investigación.
[6] Legislación y bioética aplicadas
al campo de la investigación
e innovación clínica
2. Legislación en investigación clínica
En este capítulo, ligado al objetivo de conocer los resultados de la utilización de medicamentos una vez comercializados, se aborda el marco legislativo de la investigación clínica con medicamentos fuera del ámbito de los ensayos clínicos. Los especialistas en farmacia hospitalaria deben conocer la normativa aplicable a los estudios postautorización (EPA) ya que pueden participar como promotores o investigadores de los mismos.
En la tabla siguiente se recoge la legislación de aplicación en la investigación con medicamentos.
Ángela Gil Martín
Comunidad de Madrid
Legislación en investigación clínica
Recopilación normativa
| Investigación clínica |
|
| Protección de datos y autonomía del paciente |
|
| Ensayos clínicos |
Normativa europea
|
Normativa estatal
|
| Estudios postautorizacion (EPA) |
Normativa europea
|
Normativa estatal
|
|
Normativa autonómica Cada comunidad autónoma puede haber desarrollado en su ámbito una normativa específica sobre EPA que se habrá de tener en cuenta para poner en marcha el EPA en cada comunidad. La información al respecto está disponible en la página web de la AEMPS: http://www.aemps.gob.es/investigacionClinica/medicamentos/estudiosPostautorizacion.htm. |
|
Guías para el desarrollo de los EPA Aunque no son de obligado cumplimiento, la aplicación de estas guías aporta calidad al desarrollo del EPA y, por tanto, a los resultados obtenidos.
|
Ángela Gil Martín
Comunidad de Madrid
Recopilación normativa
Estudios postautorización
Los EPA se consideran necesarios para la obtención de un conocimiento que los ensayos clínicos controlados, realizados durante el desarrollo clínico de los fármacos, no aportan y que es esencial para orientar la práctica clínica y favorecer el uso racional de los medicamentos.
Orden SAS/3470/2009, de 16 de diciembre, por la que se publican las directrices sobre estudios posautorización de tipo observacional para medicamentos de uso humano. Disponible en: https://www.boe.es/buscar/pdf/2009/BOE-A-2009-20817-consolidado.pdf [consultado 18 de septiembre de 2017].
Procedimiento administrativo para los estudios postautorización de tipo observacional
De manera resumida, el procedimiento normativo que es aplicable a estos estudios comprende tres fases: clasificación, autorización y seguimiento:
1 Clasificación: todos los estudios clínicos o epidemiológicos no aleatorizados que se realicen en seres humanos o con sus registros médicos y que recojan información sobre medicamentos deben solicitar la clasificación a la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
2 Autorización: todos los estudios, con independencia de su clasificación, deben presentarse a un comité de ética de la investigación (CEI) acreditado en España y obtener su dictamen favorable antes del mismo.
3 Seguimiento: el promotor de los EPA de seguimiento prospectivo debe enviar informes de seguimiento anuales a la AEMPS y a las comunidades autónomas o CEI implicados, así como notificar las sospechas de reacciones adversas graves de los medicamentos que sean objeto de estudio.
- Orden SAS/3470/2009, de 16 de diciembre, por la que se publican las directrices sobre estudios posautorización de tipo observacional para medicamentos de uso humano. Disponible en: https://www.boe.es/buscar/pdf/2009/BOE-A-2009-20817-consolidado.pdf [consultado
-Instrucciones para la solicitud de clasificación de estudios posautorización de tipo observacional con medicamentos de uso humano. AEMPS (09/03/2011). Disponible en: https://www.aemps.gob.es/investigacionClinica/medicamentos/docs/estudios-PA/instrucciones-clasificacion_estudios-PA.pdf [consultado 18 de septiembre de 2017].
- Documento de preguntas y respuestas sobre estudios posautorización de tipo observacional con medicamentos de uso humano y sobre la aplicación de la Orden SAS/3470/2009.AEMPS (V.2 25/07/2012). Disponible en: https://www.aemps.gob.es/investigacionClinica/medicamentos/docs/estudios-PA/FAQ-estudios-PA_orden-SAS-3470-2009.pdf [consultado 18 de septiembre de 2017].
- Real Decreto 1090/2015, de 4 de diciembre, por el que se regulan los ensayos clínicos con medicamentos, los Comités de Ética de la Investigación con medicamentos y el Registro Español de Estudios Clínicos. Disponible en: https://www.boe.es/boe/dias/2015/12/24/pdfs/BOE-A-2015-14082.pdf [consultado 18 de septiembre de 2017 18 de septiembre de 2017].
Rutas administrativas de los estudios postautorización



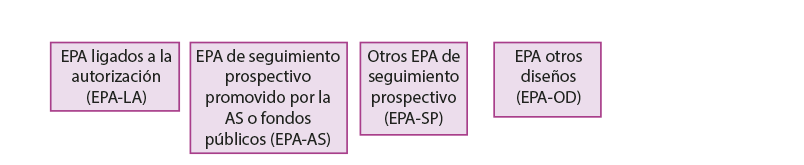







AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; AS: Administración Sanitaria; CEIC: comité ético de investigación científica; EPA: estudios postautorización.
[6] Legislación y bioética aplicadas
al campo de la investigación
e innovación clínica
3. Bioética de la investigación e innovación
La bioética surge como respuesta a los escenarios del avance científico-técnico y como espacio de reflexión para orientar las decisiones de los profesionales en conflictos morales que surgen de la aplicación de tales avances.
Ética principialista aplicada a la investigación e innovación
Se definen los cuatro principios que se aplican a:
Beneficencia
Intrínsecamente ligado al fin de la medicina, supone buscar siempre el beneficio del paciente.
La beneficencia se asimila en términos científicos a la eficacia.
Este principio incide directamente sobre el diseño del estudio ya que implica decidir qué sujetos se incluyen o excluyen, qué variables se van a utilizar y cómo se van a medir, la viabilidad y las limitaciones del estudio.
No maleficiencia
Unido al principio de beneficencia, se enuncia como no hacer aquello que pueda causar más daño que beneficio, “Primun non nocere”.
Todo nuevo producto, instrumento, dispositivo, procedimiento, material o prótesis que se pretenda introducir como herramienta para el diagnóstico o la terapia debe someterse a comprobaciones exhaustivamente evaluadas respecto a su eficacia y seguridad.
Autonomía
Este principio supone el respeto a las personas para decidir voluntariamente participar en la investigación. La información es la base de la autonomía y se considera un derecho del paciente/sujeto de la investigación.
El fundamento del consentimiento informado es el respeto a la autonomía del paciente y su dignidad.
Justicia
El principio de justicia implica tratar a cada uno como corresponda con la finalidad de disminuir las situaciones de desigualdad, ya sea ideológica, social, cultural, económica, etc.
Aplicar el principio de justicia en la investigación e innovación no es fácil. En general los proyectos internacionales están regidos por las necesidades de los mercados y se descuidan enfermedades y problemas sociales prevalentes en países pobres.
Si los tres principios enunciados anteriormente se refieren al bien individual, el principio de justicia hace referencia al bien común, al de la sociedad en su conjunto.
Desafíos éticos en la innovación
¿Todo lo técnicamente posible es éticamente aceptable? Si es posible, y hay medios para realizarlo, ¿cómo y quién pondrá límites para asegurar que se ayuda al progreso humano?
Un dilema actual en la sociedad del conocimiento, donde la constante es el cambio, es poner límites a la investigación científico-técnica.
La evaluación ética de una innovación supone:
- Elegir los medios adecuados.
- Valorar si los fines son aceptables para los involucrados.
- Valorar los resultados y el impacto en la sociedad y la cultura.
Eva Negro Vega
Hospital Universitario de Getafe. Madrid
Desafíos éticos en la innovación
Responsabilidad de los científicos
Saber implica una responsabilidad moral, la condición de expertos de científicos y tecnólogos les crea un compromiso ante la sociedad, que requerirá su opinión autorizada.
La Guía de Buena Práctica Clínica es una norma internacional de calidad ética y científica que define el conjunto de procedimientos para llevar a cabo ensayos clínicos con medicamentos garantizando el respeto a los principios éticos y la credibilidad de los resultados. Su cumplimiento garantiza públicamente la protección de los sujetos del ensayo, de futuros participantes en ensayos y de la población que sea posteriormente tratada con los medicamentos autorizados tras la investigación. La norma recoge las responsabilidades de todos los agentes que participan en la investigación: comités éticos, promotores e investigadores, así como las directrices sobre documentación y registro de datos.
Normas de Buenas Prácticas Clínicas (CPMP/ICH/135/95). Disponible en: https://www. aemps.gob.es/industria/inspeccionBPC/docs/guia-BPC_octubre-2008.pdf [consultado 18 de septiembre de 2017].
Big data
La incorporación del análisis masivo de datos como herramienta de investigación abre muchos interrogantes tanto para los investigadores como para la sociedad en general.
El documento de opinión sobre bioética y big data de salud de Llâcer et al., pretende alertar sobre la necesidad de crear una cultura de la privacidad en materia de datos personales, ya que estos se han convertido en elementos o dispositivos de control en una sociedad informatizada, y es preciso ser conscientes de por qué y para qué deben protegerse. Los derechos a la intimidad, la confidencialidad y la no discriminación son pilares del sistema de salud y de la investigación.
Llâcer MR, Casado M, Buisan L, coordinadores. Documento sobre bioética y Big Data de salud: explotación y comercialización de los datos de los usuarios de la sanidad pública. Barcelona: Observatori de Bioêtica i Dret. Universitat de Barcelona; 2015.
Acceso y valor de la innovación, ¿derecho o privilegio?
El acceso a la innovación, y más concretamente a la innovación en salud, es considerado un derecho por los ciudadanos de los países más desarrollados, mientras que en otros colectivos desfavorecidos se considera un privilegio.
Un punto de especial importancia en este tema es conocer el valor de la innovación, ya que los criterios de acceso se van a fijar en función del resultado esperado de la misma. Para los medicamentos, entre los criterios establecidos en la ley6 para la financiación pública, se consideran: gravedad de la enfermedad, necesidades específicas de ciertos colectivos, valor terapéutico y social, beneficio clínico incremental en relación al coste-efectividad y grado de innovación.
- Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios
- Ministerio de Sanidad, Servicios Sociales e Igualdad. Plan Estratégico para el abordaje de la Hepatitis C en el Sistema Nacional de Salud
Eva Negro Vega
Hospital Universitario de Getafe. Madrid
Big data
[6] Legislación y bioética aplicadas
al campo de la investigación
e innovación clínica
Test de autoevaluación
-
1. En 1947 se alcanzó el primer consenso internacional para regular la investigación en seres humanos, el Código de Nüremberg. Posteriormente, diversas organizaciones internacionales han generado pautas, normas o reglamentos al respecto. Principles of Biomedical Ethics, de Beauchamp y Childress, se considera el texto de referencia en bioética. En él se definen cuatro principios:
- Beneficencia. Supone buscar siempre el beneficio del paciente, a pesar de que ello pueda perjudicarle más que beneficiarle.
- No maleficencia. No hacer aquello que pueda causar más daño que beneficio.
- Autonomía. Los investigadores deben decidir quien participa en la investigación.
-
2. La evaluación ética de una innovación supone:
- Únicamente valora los resultados y el impacto en la sociedad y la cultura.
- Únicamente valora si los fines son aceptables para los involucrados.
- Valora tanto los resultados y el impacto en la sociedad como si los fines son aceptables para los involucrados.
-
3. ¿Qué ocurre cuando no hay consenso entre los que quieren desarrollar un proyecto, los que lo evalúan y los afectados?:
- Prevalece la postura de los que lo evalúan, puesto que en este caso no tiene sentido buscar una solución de consenso.
- En el caso de España, con relación a estudios con fármacos, la solución se hallará en el Real Decreto 1090/2015, de 4 de diciembre.
- El principio de precaución establece que se tomen medidas preventivas cuando existan bases razonables para creer que la aplicación de un proyecto puede resultar peligrosa para el ecosistema y para la sociedad.
-
4. La declaración de Helsinki de 2013 introduce dos tipos diferentes de obligaciones posinvestigación: acceso a la atención de la salud y acceso a la información.
- Los beneficiarios de estas obligaciones son los participantes individuales de los estudios de investigación
- Los beneficiaros de las obligaciones establecidas en esta declaración son los patrocinadores e investigadores
- La sociedad es la beneficiaria de las obligaciones establecidas en esta declaración.
-
5. En la investigación clínica, los estudios posautorización:
- Se consideran necesarios en el proceso de autorización de un medicamento.
- Tienen como objetivo el estudio de las características farmacocinéticas del medicamento.
- Se definen como cualquier estudio clínico o epidemiológico realizado durante la comercialización de un medicamento en las condiciones normales de uso.
[7] Innovación abierta
en salud
1. Introducción
La innovación abierta tiene un punto de partida muy sencillo: romper las fronteras de la unidad y buscar las oportunidades de mejora más allá del servicio de farmacia. En un contexto de organizaciones que fluyen y de un intercambio constante de conocimiento, este tipo de innovación es la única herramienta para transformar nuestro entorno.
La innovación abierta tiene que ver con la participación en los procesos de innovación y así, la llegada de clientes, consumidores, universidades, centros de investigación o incluso competidores genera un nuevo escenario para la innovación: más difícil de manejar, también más líquido pero mucho más potente y ágil.
Existe la posibilidad de que las ideas para una organización pudieran venir desde fuera.
Chesbrough H. Open innovation: the new imperative for creating and profiting from technology. Boston: Harvard Business School; 2003.
Chesbrough H. The logic of open innovation: managing intellectual property. California Management Review. 2003;45(3):33-58.
Chesbrough H. The era of Open Innovation. MIT Sloan Management Review. 2003;44(3):35-41.
Miguel Angel Máñez Ortiz
Servicio Madrileño de Salud
Nuevo paradigma en el mundo de las organizaciones
Asimismo se defiende el papel de los usuarios (clientes) en la creación y rediseño de productos y servicios.
Von Hippel E. Democratizing innovation. London: MIT Press Books; 2005.
Miguel Angel Máñez Ortiz
Servicio Madrileño de Salud
Modelo de innovación abierta
Un ejemplo muy conocido es el del diseño de las bicicletas de montaña, ya que fue un grupo de usuarios el que decidió adaptar las bicicletas convencionales para su uso en terrenos montañosos. Para ello utilizaron estructuras de bicicletas, junto con piezas de motocicletas y otras bicicletas. Los fabricantes de bicicletas no se dieron cuenta de esta necesidad hasta que empezaron a verse por los caminos. El usuario se había adelantado al mundo de la empresa.
El nuevo modelo promueve que las fronteras de la organización sean permeables y permitan que el conocimiento entre y salga de forma muy sencilla. Una de las grandes barreras y retos es superar el síndrome NIH (not invented here), un síndrome que surge cuando, por orgullo o ignorancia, se decide reinventar la rueda en vez de utilizar un conocimiento ya disponible pero ajeno.
Lüthje C, Herstatt C, von Hippel E. User-innovators and “local” information: The case of mountain biking. Research Policy. 2005;34(6):951-65.
Katz R, Allen TJ. Investigating the not invented here (NIH) syndrome: a look at the performance, tenure, and communication patterns of 50 R&D Project groups. R&D Management. 1982;12(1):7-19.
Miguel Angel Máñez Ortiz
Servicio Madrileño de Salud
Permeabilidad en las fronteras de la organización
Proceso de innovación abierta frente a la innovación cerrada
Chesbrough H. The era of Open Innovation. MIT Sloan Management Review. 2003;44(3):35-41.
[7] Innovación abierta
en salud
2. Tipología y fuentes de la innovación abierta
Hay tres tipos de procesos en el campo de la innovación abierta:
- Hacia dentro (inside-out): mejorar el conocimiento de la organización integrando a clientes, proveedores y cualquier otra fuente de conocimiento externo.
- Hacia fuera (inside-out): difundir ideas o conocimiento interno mediante una transferencia de conocimiento a fuentes externas.
- Mixto: se trata de una combinación de ambos tipos, principalmente mediante alianzas con agentes externos.
Fuentes de conocimiento para la innovación:
1. Fuentes internas
2. Mercado
3. Instituciones
4. Espacios de intercambio
5. Fuentes especializadas
El liderazgo como factor de éxito para proyectos de innovación abierta: si bien el modelo de innovación aparenta ser informal y sin organización, es imprescindible que exista un liderazgo que evite problemas, motive a los miembros del equipo a compartir su conocimiento, genere un clima de confianza para facilitar el intercambio y promueva un cambio cultural para que este tipo de innovación se incorpore a los usos y costumbres de cada organización.
Gassmann O, Enkel E. Towards a theory of open innovation: three core process archetypes. R&D Management Conference; 2006.
Laursen K, Salter S. Open for innovation: The role of openness in explaining innovation performance among UK manufacturing firms. Strategic Mangement Journal. 2006;27:131-50.
Bravo-Ibarra ER, Herrera L. Capacidad de innovación y configuración de recursos organizativos. Intangible Capital. 2009;5(3):301-20.
-
Miguel Angel Máñez Ortiz
Servicio Madrileño de Salud
Liderazgo
[7] Innovación abierta
en salud
3. Innovación abierta en farmacia hospitalaria
Debido a su situación estratégica dentro del propio proceso, el farmacéutico de hospital siempre ha colaborado en beneficio del paciente compartiendo conocimientos con el resto de agentes involucrados en la cadena de uso del medicamento.
Al igual que nuestro sistema sanitario, la farmacia hospitalaria también necesita renovar su modelo debido al aumento progresivo de competencias adquiridas por el farmacéutico de hospital y a las nuevas necesidades de los pacientes y del SNS respecto al uso de los medicamentos. El modelo que se demanda está más orientado a las necesidades del paciente (accesibilidad, humanización, calidad percibida y satisfacción en la atención farmacéutica), a los resultados en salud de los medicamentos y a la aportación de valor añadido real para nuestros pacientes, otros clientes (externos e internos) y el propio sistema sanitario.
Arenaza AE, Blasco I, Cajaraville G, Calle C, Calleja MA, Cañadas M, et al. 12 experiencias para transformar la Farmacia Hospitalaria [internet]. www.Sefh.es. 2016.
Bermejo T, Calleja MA, Cañadas ML, del Llano-Señarís JE, Hidalgo A, Mangues MA, et al. 10 temas candentes de la Farmacia Hospitalaria [internet]. www.sefh.es. 2015
Juan Alfredo Montero Delgado
Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
Proceso de innovación abierta en farmacia hospitalaria
La innovación dentro de un servicio de farmacia hospitalaria (SFH) es una línea estratégica transversal que permite su mejora continua, aportando valor extra a los procesos y suprimiendo aquellos ineficaces. Fomentar la cultura innovadora dentro de un SFH abriéndola más allá de sus fronteras es una estrategia óptima para la mejora continua y para ser de mayor utilidad en el seno del hospital, pero también fuera del mismo.
La necesidad de “reinventarse” de la farmacia hospitalaria requiere de una estrategia innovadora que sea colaborativa, permeable y multidireccional, y donde la resolución de problemas esté más orientada a las necesidades del paciente y menos al medicamento. Esto permitiría el acceso del talento externo y la exploración de nuevos servicios y competencias del farmacéutico de hospital.
La posición del farmacéutico dentro del proceso farmacoterapéutico ha permitido establecer relaciones profesionales con todos los agentes implicados dentro del mismo (industria farmacéutica, gestores, instituciones sanitarias, prescriptores, personal de enfermería, pacientes, etc.). Por el mismo motivo es frecuente también que existan conexiones con el ámbito académico (universidades) e investigador (centros de I+D+i). Sin embargo, uno de los potenciales agentes externos cuya relación con la farmacia hospitalaria está por explorar son, por ejemplo, las “startups de salud”.
Debido a la cantidad de partners potenciales que tiene la farmacia hospitalaria, es razonable pensar que el farmacéutico hospitalario se encuentra en una situación privilegiada para promover, impulsar, coordinar y liderar proyectos de innovación abierta que estén relacionados con medicamentos y la mejora de sus resultados en salud en los pacientes.
Asimismo, el farmacéutico de hospital, como profesional sanitario experto en medicamentos y su entorno, tiene conocimientos y competencias para ejercer el papel de “partner de salud” de los diferentes agentes dentro de un modelo de innovación abierta, ya sea en funciones clínicas directas, gestoras y/o consultoras, como de investigación tanto clínica como traslacional.
El modelo de innovación abierta facilita la generación de ideas entre cualquier profesional sanitario, usuario y agente externo, lo que ayuda a proporcionar nuevas propuestas de mejora capaces de generar grandes cambios en la forma de concebir un SFH, un hospital o el propio sistema sanitario.
Huete L, Herranz A. La innovación en farmacia hospitalaria. Farmacia Hospitalaria. 2009;33(1):1-3.
Proceso de innovación abierta en farmacia hospitalaria
A pesar de que la innovación abierta es aún una desconocida dentro de los SFH, esta es susceptible de complementar a la innovación habitual en cualquiera de sus áreas habituales, pudiendo así aportar un nuevo enfoque a cada proceso gracias a la visión y colaboración externa que proporciona el resto de agentes colaboradores, incluidos los pacientes.
Sociedad Española de Farmacia Hospitalaria. Monografías de Farmacia Hospitalaria y de Atención Primaria: Innovación en Procesos nº 7. Barcelona: Bayer Hispania SL; 2017
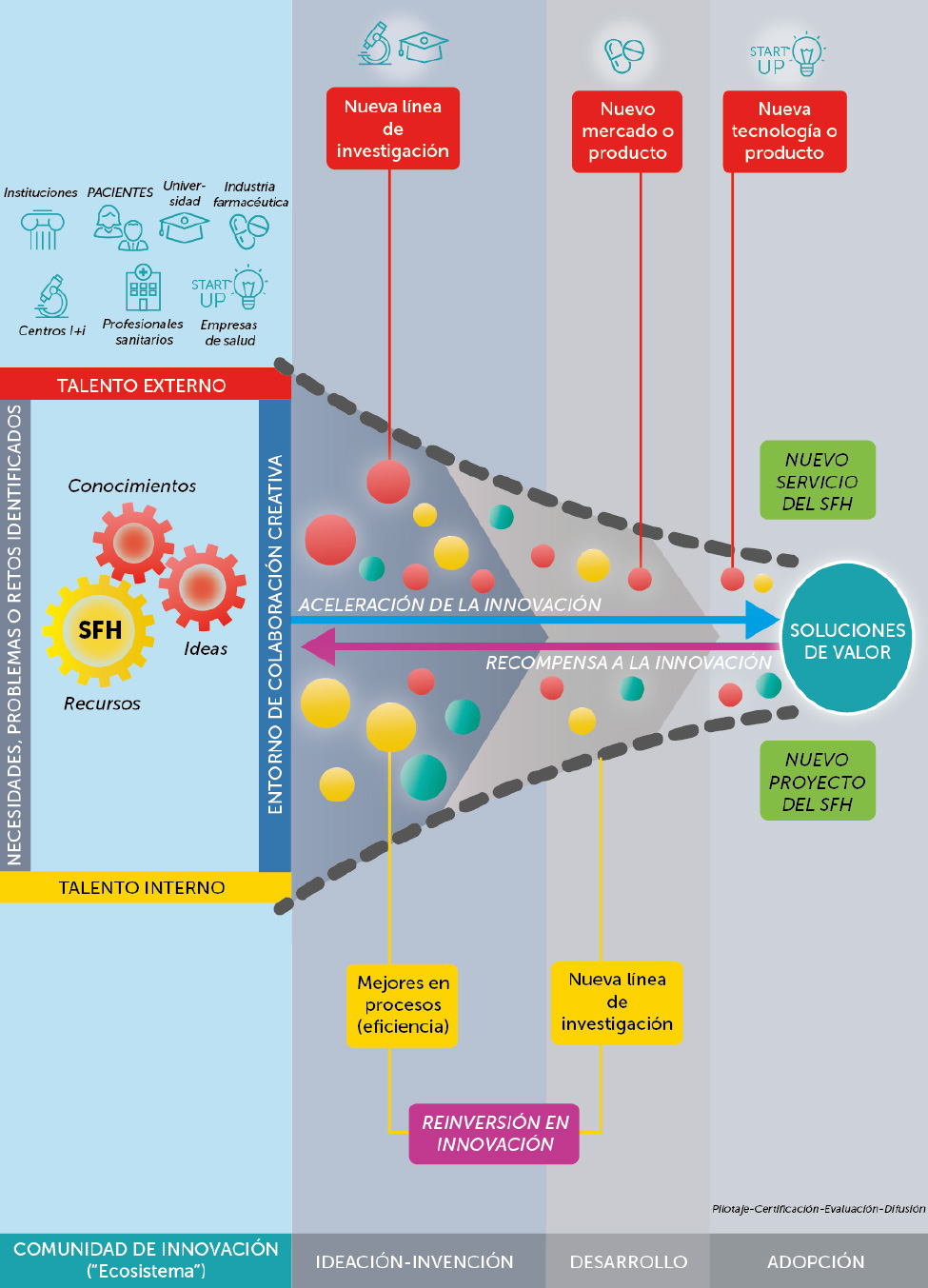
Priyadarshini A, Quinlan M, Doyle G. Connected Health: An open innovation perspective. Applied Clinical Research, Clinical Trials and Regulatory Affairs. 2017;4(1):55-9.
Algunas acciones y estrategias para impulsar la innovación abierta en un SFH son las siguientes:
- Incorporar al farmacéutico de hospital dentro del comité de innovación del hospital.
- Crear un área específica para la innovación y la investigación del SFH, como por ejemplo iPHARMA del Hospital Gregorio Marañón.
- Realizar talleres de innovación con pacientes para conocer su visión: los productos y servicios que cuentan desde las fases iniciales del proyecto con el usuario (paciente) tienen una probabilidad de éxito mayor.
- Realizar reuniones interdisciplinares de innovación con diferentes colaboradores internos y externos del hospital, para buscar soluciones a problemas comunes del hospital o específicos del SFH.
- Organizar eventos o jornadas interdisciplinares (tipo “Hackathon”).
- Construir y utilizar una plataforma de innovación abierta para nuestro “ecosistema”.
Líneas de investigación del Servicio de Farmacia del Hospital Gregorio Marañón (Madrid, España) [Internet]. Madrid.org. 2017
Juan Alfredo Montero Delgado
Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
[7] Innovación abierta
en salud
Test de autoevaluación
-
1. El modelo de innovación abierta se contrapone al tradicional en que incorpora la participación de agentes externos (clientes, consumidores, universidades, centros de investigación e, incluso, competidores). En el nuevo paradigma:
- Los antiguos Departamentos de Investigación, Desarrollo e Innovación tienen una importancia renovada.
- La globalización y el uso de nuevas tecnologías desempeñan un papel importante.
- Los usuarios (consumidores) no tienen un rol relevante en la creación y rediseño de productos y servicios.
-
2. La innovación abierta busca resolver algunos de los problemas que tradicionalmente se asocian a los modelos de innovación en el sector sanitario:
- Aunque las innovaciones en el sector se adoptan de forma rápida, se difunden lentamente.
- Buena parte de la innovación nace en centros alejados de la realidad asistencial.
- Gran parte de la innovación está dirigida por gerentes sanitarios, lo que dificulta que las propuestas de otros sectores sean tenidas en cuenta.
-
3. El modelo actual del Sistema Nacional de Salud es ineficiente y se enfrenta al envejecimiento progresivo de la población, el aumento de la prevalencia de las enfermedades crónicas y la cronificación de enfermedades que antes eran mortales. La necesaria transformación debe pasar por:
- Asumir las decisiones, liberando al paciente de la toma de decisiones y de su cuidado.
- Nuevas formas de financiación, que prioricen el pago por servicios prestados.
- Invertir en investigación traslacional e innovación sanitaria; desinvertir en todo aquello que no cumpla con criterios de medicina basada en la evidencia o de coste-efectividad y que no aporten valor añadido.
-
4. El sector farmacéutico es uno de los mayores inversores en investigación, desarrollo e innovación. Actualmente, su modelo de innovación (lineal, unidireccional y cerrado) ha quedado en entredicho en favor de uno basado en el conocimiento compartido y la colaboración con otras entidades investigadoras. Entre las ventajas que presenta la innovación abierta para la industria farmacéutica destacan:
- La multiplicación del riesgo innovador, que es asumido por varios agentes.
- La aceleración de la innovación y la reducción del periodo de tiempo hasta la comercialización del producto.
- La externalización de los recursos y el talento investigador.
-
5. La farmacia hospitalaria también necesita renovar su modelo, debido al aumento de las competencias adquiridas y a las nuevas necesidades de los pacientes y del sistema sanitario respecto al uso de medicamentos. Algunas acciones y estrategias para impulsar la innovación abierta en un Servicio de farmacia hospitalaria son:
- Hacer talleres en los cuales forme al farmacéutico de hospital en las técnicas de investigación.
- Realizar reuniones interdisciplinarias con colaboradores internos del hospital, puesto que los colaboradores externos solo pueden aportar confusión en los objetivos.
- Crear un área específica para la innovación e investigación del Servicio de farmacia e incorporar al farmacéutico hospitalario al comité de innovación del hospital.
[8] Big data y su utilidad
en investigación
e innovación sanitaria
1. Introducción
Nos dirigimos exponencialmente hacia un lugar en que distintas tecnologías disruptivas convergerán para transformar el modelo sanitario en una atención basada en grandes bases de datos y en los consiguientes algoritmos de inteligencia artificial que de ellas se derivan. Esto se traducirá previsiblemente en una mejora de los resultados en salud y de la eficiencia del sistema sanitario.
Muchas de las industrias que eran previamente analógicas han venido digitalizándose progresivamente (por ejemplo, la música, la banca, etc.), de forma que han pasado del mundo físico al soporte informático. Lo interesante de la digitalización en cualquier campo es que hace todo más accesible, más barato; lo democratiza. La medicina no tiene por qué ser diferente y parece que ya le ha llegado su turno.
Elenko E, Underwood L, Zohar D. Defining digital medicine. Nat Biotechnol. 2015;33(5):456-61.
[8] Big data y su utilidad
en investigación
e innovación sanitaria
2. La inflación de la información médica:
datos exponenciales
Una pregunta que todo buen evaluador debe hacerse es: ¿realmente hace falta más salud digital o solo se trata de un grupo de emprendedores deseando hincar el diente a un sector con jugosos presupuestos y aún sin trillar?
La información médica se duplica cada 5 años y se ha calculado que en 2020 habrá 200 veces más información por especialidad de la que un médico podría absorber; hoy sabemos que los profesionales tenemos hasta una duda cada dos pacientes. Este problema se agrava en el caso de las especialidades generalistas. A diferencia de lo que sucedía en épocas pasadas, hoy ya no tenemos tiempo para mantenernos actualizados. Este hecho explica bien por qué solo una de cada cinco decisiones médicas está rigurosamente basada en la evidencia. Este fenómeno tan incómodo, el de la variabilidad, es sin duda uno de los peores enemigos de nuestros pacientes. Es ahí donde los profesionales nos dotamos de una nueva arma para hacer frente a todo este fenómeno, una herramienta que permite agrupar el conocimiento colectivo haciendo valer a las mindlines frente a las guidelines: esto es el big data aplicado a sanidad.
Kocher B, Roberts B. Why so many new tech companies are getting into health care [Internet]. Harvard Bus. 2014 Dec 8.
Ignacio Hernández Medrano
Hospital Universitario Ramón y Cajal. Madrid
La inflación de la información médica: datos exponenciales.
Embudo de la evidencia: razones para la transición de guidelines a mindlines en la práctica clínica real
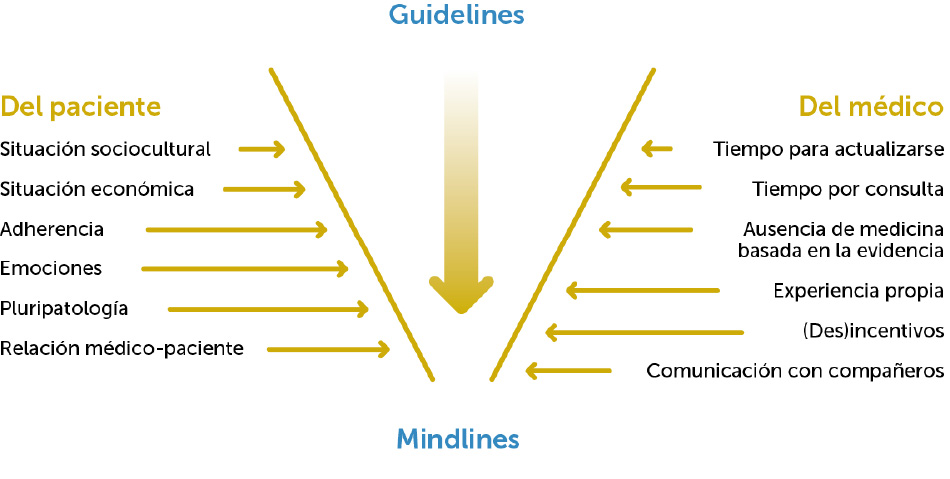
[8] Big data y su utilidad
en investigación
e innovación sanitaria
3. Inteligencia artificial
Hoy ya no tenemos tiempo para mantenernos actualizados. Ante esta situación, a los profesionales sanitarios se nos abre una posible salida: dejar progresivamente el diagnóstico y el tratamiento en manos de la computación.
Con técnicas como las “redes neuronales recurrentes” ofrecemos a la computación los secretos estructurales de nuestra corteza cerebral humana, lo que les permite aumentar su rendimiento de forma cualitativa. Hoy ya disponemos de máquinas capaces de observar imágenes, textos o vídeos, aprender de ellos y generar nueva información de creación propia. Su incorporación de patrones en el aprendizaje, como hace un niño cuando va al colegio o experimenta, está abriendo brechas en la gestión del conocimiento de repercusión aún no imaginable.
Ignacio Hernández Medrano
Hospital Universitario Ramón y Cajal. Madrid
[8] Big data y su utilidad
en investigación
e innovación sanitaria
4. Big data y farmacia hospitalaria
En 2007, la Sociedad Americana de Farmacia Hospitalaria (ASHP) publicó un documento de posicionamiento que describe el papel del farmacéutico en informática para la salud, y definió esta área de subespecialidad de la práctica farmacéutica como el uso e integración de datos, información, conocimiento, tecnología y automatización en el proceso de uso de medicamentos con el propósito de mejorar los resultados de salud.
Proceedings of the Pharmacy Practice Model Summit: An invitational consensus conference conducted by ASHP and the ASHP Research and Education Foundation, November 7-9, 2010, Dallas, Texas.
Aplicaciones del big data en farmacia hospitalaria
Existen diferentes formas en las que la farmacia hospitalaria puede obtener beneficio con la explotación de datos procedentes de big data. Podemos destacar tres: la toma de decisiones, la mejora de la prestación farmacéutica en instituciones como hospitales y farmacias comunitarias, y la mejora de la calidad y la medición de resultados en salud.
Padwal R, Kezouh A, Levine M, Etminan M. Long-term persistence with orlistat and sibutramine in a population-based cohort. Int J Obes (Lond). 2007;31(10):1567-70.
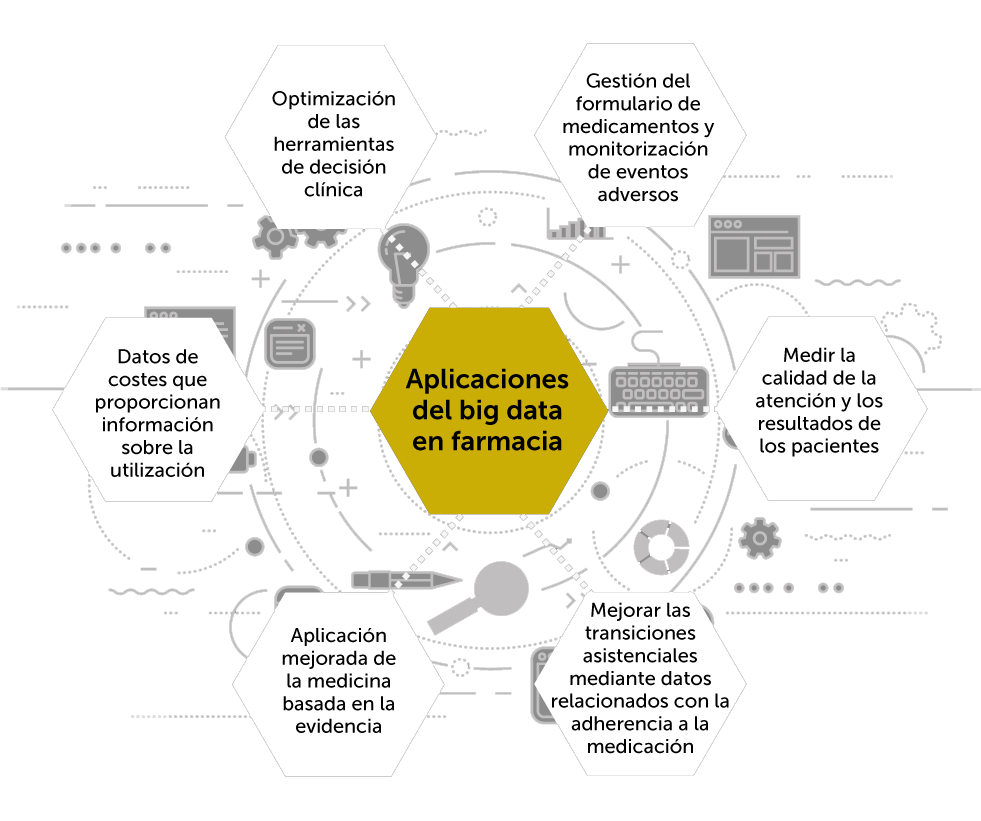
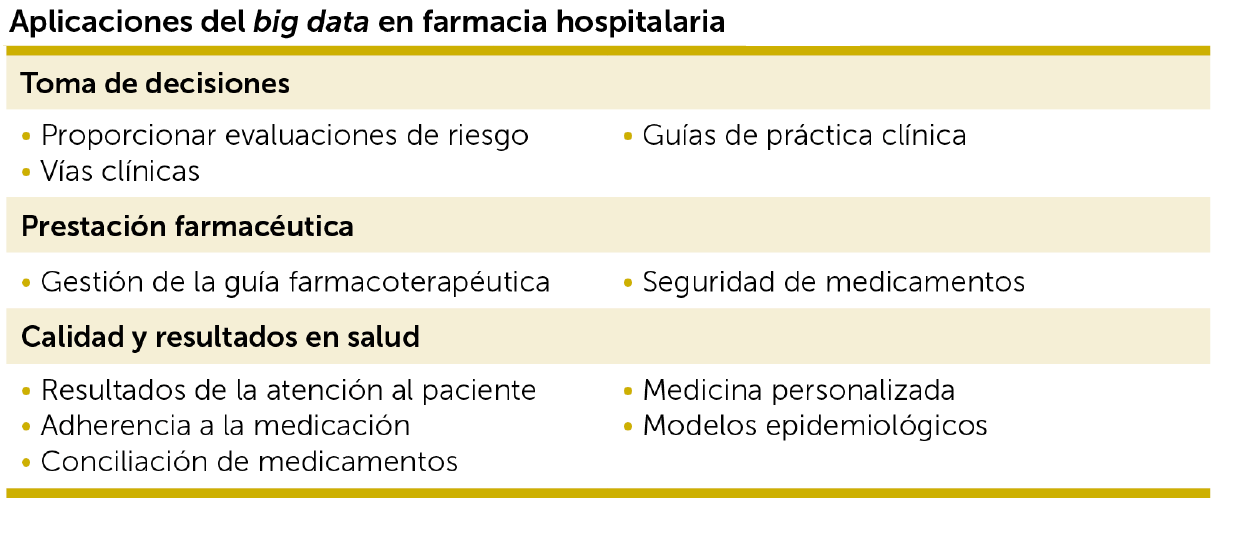
Ma C, Smith HW, Chu C, Juarez DT. Big Data in pharmacy practice: current use, challenges, and the future. Integr Pharm Res Pract. 2015;4:91-9.
Toma de decisiones
Vías clínicas
Las vías clínicas son un ejemplo de soporte a la toma de decisiones. Originalmente fueron diseñadas para controlar los costes de atención médica sin sacrificar la calidad de la prestación, dirigiéndose a diagnósticos o procedimientos de alto volumen, alto coste y/o de alto riesgo en los sistemas de atención de la salud. Los farmacéuticos han participado durante mucho tiempo en el desarrollo de vías clínicas.
McCaffrey S, Nightingale CH. How to develop critical paths and prepare for other formulary management changes. Hosp Formul. 1994;29:628-35.
Sergio Plata Paniagua
Gerencia de Atención Integrada de Albacete
Toma de decisiones
Prestación farmacéutica
Gestión de la guía farmacoterapéutica
Dependiendo del tamaño del sistema de salud, se pueden utilizar big data para decidir el manejo de la guía farmacoterapéutica entre múltiples instituciones.
Seguridad del medicamento
El big data ha demostrado ser útil en la evaluación de la seguridad de los medicamentos ya que permite establecer relaciones causales. Por tanto, puede suponer un punto de inflexión a la hora de la detección de eventos adversos con un determinado fármaco o en la prevención de errores de medicación gracias a la integración y análisis de estos datos.
Calidad y resultados en salud (indicadores)
La mayoría de las historias clínicas electrónicas disponen de herramientas de apoyo a la decisión clínica para guiar la prescripción más apropiada de la medicación. Las herramientas de apoyo a la toma de decisiones clínicas relacionadas con la farmacia incluyen alertas de dosis de medicación, duplicidades, interacciones entre fármacos y advertencias para alertar a los usuarios de prácticas potencialmente peligrosas. Las historias clínicas electrónicas también contienen datos económicos, operativos y genéticos de los que se puede disponer para evaluar la conveniencia de las opciones de tratamiento individualizados de los pacientes y, de esta forma, aumentar la eficiencia y mejorar la calidad de la atención proporcionada.
[8] Big data y su utilidad
en investigación
e innovación sanitaria
Test de autoevaluación
-
1. ¿Qué es el big data?:
- El análisis masivo de gran cantidad de información, gracias al cual los ordenadores pueden detectar correlaciones que podrían no ser observadas de otro modo.
- La gestión y análisis de grandes cantidades de datos con software convencional.
- El término se aplica a las grandes bases de datos.
-
2. ¿Realmente hace falta más salud digital o solo se trata de un pequeño grupo de emprendedores deseando hincar el diente a un sector con jugosos presupuestos y aún sin trillar?:
- Se estima que la información médica se duplica cada 20 años.
- Se ha calculado que en 2020 habrá 200 veces más información por especialidad que la que un médico podría absorber.
- Solo una de cada tres decisiones médicas está rigurosamente basada en la evidencia.
-
3. Existen diferentes formas en las que la farmacia hospitalaria puede obtener beneficio con la explotación de datos procedentes de big data, entre ellas las siguientes:
- La gerencia administrativa.
- La rapidez de la prestación farmacéutica.
- La mejora de la calidad y la medición de los resultados en salud.
-
4. La conciliación de la medicación es el proceso mediante el cual se comparan los medicamentos que un paciente tiene prescritos en un centro médico con todos los medicamentos que toma de forma ambulatoria:
- Esta conciliación se realiza para evitar burocracia.
- Esta conciliación se realiza para intentar reducir el gasto del sistema sanitario en fármacos.
- Los farmacéuticos pueden aprovechar el big data para facilitar la conciliación de medicamentos.
-
5. Entre los retos del big data en farmacia hospitalaria se encuentran los retos tecnológicos que plantea el gran volumen de datos:
- De comprensión.
- De transmisión segura de los datos.
- De problemas de decisión a la hora de saber qué datos analizar y cuál es la herramienta adecuada para ello.
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
1. Introducción
El desarrollo de un proyecto de investigación es una carrera de fondo. Requiere ilusión, dedicación y perseverancia, pero también recursos económicos y humanos. En este capítulo se describen concisamente los elementos necesarios para poder llevar a cabo un proyecto de investigación de manera exitosa.
La farmacia hospitalaria es una especialización profesional farmacéutica que, por su naturaleza de ciencia de la salud, requiere una actualización continua debido a la incorporación de los resultados derivados de investigaciones de calidad.
Para facilitar la investigación se han creado los llamados institutos de investigación sanitaria, que son centros de investigación físicamente localizados en los hospitales y que están estrechamente relacionados con las facultades de ciencias de la salud de las universidades cercanas. Los IIS llevan intrínseca la investigación orientada al paciente con tintes básicos.
Habitualmente se inicia el proceso de investigación cuando se buscan respuestas o soluciones a situaciones de la práctica habitual que se ven como un problema o como una oportunidad de mejora.
Ana García Robles
Hospital Universitari i Politècnic La Fe. Valencia
Esquema general del proceso de investigación.








[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
2. Antes de empezar a escribir
Antes de empezar a escribir nos deberíamos preguntar:
- ¿Por qué es importante este proyecto? ¿Qué aporta? ¿En qué se diferencia de los demás?
- ¿Qué trámites legales necesita cumplir? ¿Cuánto tiempo y/o dinero van a suponer?
- ¿Qué recursos necesita? ¿Necesita financiación? ¿Quién la puede proporcionar? ¿Por qué deberían estar interesados en financiarlo?
Virginia Bosó Ribelles
Hospital Universitari i Politècnic La Fe. Valencia
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
3. Estructura de un proyecto de investigación
Aunque existen elementos comunes, la estructura y extensión de los proyectos de investigación no tiene por qué ser siempre la misma, ya que depende de las exigencias de la institución u organismo ante el que se presenta y de la finalidad del proyecto.
Virginia Bosó Ribelles
Hospital Universitari i Politècnic La Fe. Valencia
Título y resumen
Son las partes más leídas del proyecto y claves para causar una buena primera impresión en el evaluador o potencial colaborador, aunque generalmente no se les presta la atención que merecen.
Antecedentes y estado actual del tema
Base científica sobre la que se asienta la hipótesis del proyecto de investigación. Todo proyecto se sustenta sobre el sólido conocimiento del campo específico de investigación, de modo que es imprescindible llevar a cabo una revisión de la bibliografía existente hasta el momento que fundamente la pregunta de investigación y que incluya tanto las referencias más relevantes como las más recientes.
Llorca Díaz J, Delgado Rodríguez M. Elaboración de proyectos de investigación sanitaria. Barcelona: Signo; 2016.
Hipótesis y objetivos
La hipótesis debe ser un enunciado claro y conciso, sin entrar en justificaciones que deben haber quedado claras en los antecedentes.
Los objetivos deben responder a la pregunta de investigación y derivan de la hipótesis.
Métodos
Estructura de la sección Métodos de un proyecto de investigación
1 Diseño adecuado según la pregunta de investigación planteada y los medios de los que se dispone
2 Periodo de estudio
3 Población
- Ámbito de realización del estudio (población de referencia)
- Criterios de inclusión y exclusión, lo más claros posibles (evitar el error de definir los criterios de exclusión como los contrarios de los de inclusión)
- Cálculo del tamaño muestral
4 Recogida de datos
- Definición exhaustiva de las variables
- Fuentes de información
- Formas de medida de la exposición, variables respuesta y otras (p. ej., técnicas de laboratorio, historias clínicas, encuestas, etc.)
5 Análisis de los datos
- Análisis estadístico adecuado al diseño y variables incluidas
- Detallado según los objetivos
6 Limitaciones
Describir los posibles sesgos de modo objetivo
7 Aspectos éticos
Cumplimiento de todos los requerimientos éticos y legales
Plan de trabajo
El plan de trabajo, la experiencia del equipo, el marco estratégico o el presupuesto, son determinantes para conseguir financiación, ya que mostrarán al evaluador la viabilidad del proyecto de investigación, es decir, si seremos capaces de llevar a cabo el proyecto en tiempo y forma una vez concedida la financiación.
El plan de trabajo es el cronograma que incluye todas las tareas a realizar, el tiempo que se dedicará a cada una de ellas y las personas involucradas en su ejecución. Debe ser realista y ajustarse al tiempo de investigación propuesto en el proyecto.
Virginia Bosó Ribelles
Hospital Universitari i Politècnic La Fe. Valencia
Experiencia del equipo
Los investigadores, tanto el investigador principal como el equipo, deben demostrar que son capaces de llevar a cabo la investigación. Para ello no es solo importante tener un buen currículum vítae, sino demostrar que se tiene experiencia previa en el campo de estudio. El investigador principal es el líder del proyecto y responsable de su coordinación y ejecución, pero esta experiencia se deberá demostrar más allá y abarcar a todos los miembros del equipo.
Marco estratégico
Un paso previo a la solicitud de una convocatoria es comprobar si el proyecto encaja en alguna de las líneas requeridas o prioritarias de la misma. Este apartado es fundamental, ya que en él se va a encuadrar al proyecto dentro de las líneas marcadas en la convocatoria y de las prioridades de financiación del organismo convocante, sea público o privado.
Medios disponibles
Detallar todos aquellos medios de los que se dispone para la realización del proyecto y que no se solicitan como ayuda. Incluye instalaciones, equipamiento, servicios, software, etc.
Presupuesto
El primer paso para elaborar el presupuesto es revisar los costes estimados del proyecto en función del tamaño muestral, la necesidad de comprar reactivos o aparataje, el número de exploraciones o analíticas, etc. y los gastos que están financiados por la convocatoria. En función de la cuantía financiada, en ocasiones el investigador puede valorar adaptar el proyecto para poder solicitar una determinada convocatoria.
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
4. Currículum vítae
Existen muchos modelos de currículum vítae, pero tras la incorporación del currículum vítae normalizado (CVN) de la Fundación Española para la Ciencia y la Tecnología (FECYT) se ha ido progresivamente generalizando el uso de este modelo, ya que cada vez más convocatorias de financiación de proyectos de investigación, tanto públicas como privadas, lo solicitan.
Ana García Robles
Hospital Universitari i Politècnic La Fe. Valencia
El CVN se compone de ocho apartados que son:
- 1 Datos de identificación y contacto.
- 2 Situación profesional.
- 3 Formación académica recibida.
- 4 Actividad docente.
- 5 Experiencia científica y tecnológica.
- 6 Actividad científica y tecnológica.
- 7 Actividad en el campo de la sanidad.
- 8 Resumen de texto libre.
Información contenida en el currículum vítae abreviado (CVA) y localización en el currículum vítae normalizado (CVN)
| Currículum vítae abreviado | Localización en currículum vítae normalizado | ||
| Bloque | Apartado | Módulo | Apartado |
| A | DATOS PERSONALES | 1 | Identificación CVN |
| A.1. | Situación profesional actual | 2 | Situación profesional actual |
| A.2. | Formación académica | 3 | Estudios de 1er y 2º ciclo y antiguos ciclos Doctorados Otra formación universitaria de posgrado |
| A.3. | Indicadores generales de calidad de la producción científica | 6 | Indicadores generales de calidad de la producción científica |
| B | RESUMEN LIBRE DEL CURRÍCULUM | 8 | RESUMEN LIBRE DEL CURRÍCULUM |
| C.1. | Publicaciones-Méritos más relevantes | 6 | Publicaciones, documentos científicos y técnicos |
| C.2. | Proyectos-Méritos más relevantes | 5 | Proyectos de I+D+i financiados en convocatorias competitivas de administraciones o entidades públicas y privadas |
| C.3. | Contratos-Méritos más relevantes | Contratos, convenios o proyectos de I+D+i no competitivos con administraciones o entidades públicas o privadas | |
| C.4. | Patentes-Méritos más relevantes | Propiedad industrial e intelectual | |
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
5. Estudios observacionales
Se entiende como estudio observacional aquel estudio en el que los medicamentos se prescriben de la manera habitual, de acuerdo con las condiciones establecidas en la autorización. Es importante que la asignación de un paciente a una estrategia terapéutica esté determinada por la práctica habitual y el tratamiento que reciba no dependa de la decisión de inclusión en el estudio. Por supuesto, no se realizará ninguna intervención fuera de la práctica clínica, y se utilizarán métodos epidemiológicos para el análisis de los datos recogidos.
Orden SAS/3470/2009, de 16 de diciembre, por la que se publican las directrices sobre estudios posautorización de tipo observacional para medicamentos de uso humano. BOE. 2009:310:109761-75.
Virginia Bosó Ribelles
Hospital Universitari i Politècnic La Fe. Valencia
Clasificación de estudios observacionales
| Estudios observacionales que requieren una autorización adicional | |
| EPA-LA | Ligado a la autorización del medicamento La realización del estudio es una condición establecida en el momento de la autorización, o bien constituye una exigencia de la autoridad competente o forma parte de un plan de gestión de riesgos |
| EPA-AS | De seguimiento prospectivo que sea promovido por las administraciones sanitarias o financiado con fondos públicos |
| EPA-SP | De seguimiento prospectivo que no esté incluido en las categorías anteriores |
| Estudios observacionales que no requieren autorización adicional | |
| EPA-OD | Con otros diseños diferentes al seguimiento prospectivo Se engloban aquí los estudios de casos y controles, los transversales o las cohortes retrospectivas Aunque no requieren autorización previa para su realización, se debe remitir la documentación pertinente a la AEMPS |
| No-EPA | Estudios observacionales no postautorización Aun recogiendo información de medicamentos, no se considera que estos sean un factor de exposición fundamental investigado |
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; EPA: estudio postautorización.
Adaptada de Gholipour et al., 20147 y Brownson et al., 20158.
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
6. Ensayos clínicos
Para la realización de un ensayo clínico es necesario cumplimentar una serie de documentos y seguir las instrucciones que ha elaborado la AEMPS, disponibles en el enlace: https://www.aemps.gob.es/investigacionClinica/medicamentos/docs/Instrucciones-realizacion-ensayos-clinicos.pdf
Ana García Robles
Hospital Universitari i Politècnic La Fe. Valencia
Documentación necesaria para el desarrollo de un ensayo clínico
| Documentación relativa a la parte I (para enviar a la AEMPS y al CEIm) |
|
| Documentación relativa a la parte I (para enviar solo a la AEMPS |
|
| Documentación relativa a la parte II (para enviar solo al CEIm) |
|
AEMPS: Agencia Española de Medicamentos y Productos Sanitarios; CEIm: comité de ética de la investigación con medicamentos; PEI: productos en fase de investigación clínica.
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
7. Fuentes de financiación
La investigación necesita de una financiación sostenida que, en el caso de los hospitales y los IIS, puede provenir de fondos públicos, fundaciones privadas y la industria farmacéutica.
Ana García Robles
Hospital Universitari i Politècnic La Fe. Valencia
Fondos públicos
La gran mayoría de los proyectos que se desarrollan en los hospitales y sus IIS son financiados por las convocatorias del Instituto de Salud Carlos III (ISCIII).
Dependiendo de las convocatorias, el ISCIII financia fundamentalmente propuestas que puedan tener repercusión a medio y corto plazo en el SNS.
Fondos privados
Entre las fundaciones y empresas privadas que financian investigación biomédica se encuentran: Fundación Mutua Madrileña, Fundación BBVA, Fundación Farmaindustria, Fundación La Caixa, Fundación Pasqual Maragall, etc.
Respecto a los fondos provenientes de la industria farmacéutica, el hecho de estar dentro del entorno hospitalario facilita la realización de investigación clínica orientada por estas compañías.
En los nuevos modelos de investigación biomédica, los ensayos clínicos pueden ser propuestos desde los investigadores y financiados por la industria o con soporte de convocatorias públicas y privadas.
[9] Itinerario para el desarrollo
e implementación de un
proyecto de investigación
Test de autoevaluación
-
1. Aunque existen elementos comunes, la estructura y extensión de un proyecto de investigación no es siempre la misma, ya que depende de las exigencias de la institución u organismo ante el que se presenta y de la finalidad del proyecto. Por ejemplo, los “Proyectos FIS” deben tener la siguiente estructura:
- Título, antecedentes, hipótesis y objetivos, métodos, plan de trabajo, marco estratégico y presupuesto.
- Título, antecedentes y estado actual del tema, hipótesis y objetivos, métodos, plan de trabajo, medios disponibles y presupuesto.
- Título y resumen, antecedentes y estado actual del tema, hipótesis y objetivos, métodos, plan de trabajo, experiencia del equipo, marco estratégico, medios disponibles y presupuesto.
-
2. Es conveniente que el investigador conozca los aspectos regulatorios y los trámites burocráticos que deberá cumplir su proyecto:
- En España, los estudios observacionales están regulados por la Orden SAS/3470/2009, de 16 de diciembre.
- En España, los estudios observacionales están regulados por el Real Decreto 1090/2015, de 4 de diciembre.
- En España, los ensayos clínicos están regulados por la Orden SAS/3470/2009, de 16 de diciembre.
-
3. ¿Qué autorizaciones necesitan los estudios observacionales que suelen realizarse en farmacia?:
- Para empezar, la del Jefe de Servicio.
- Todos los estudios observacionales necesitan la clasificación por parte de la Agencia Española de Medicamentos y Productos Sanitarios.
- Los estudios postautorización de seguimiento prospectivo necesitarán, además, la autorización del municipio donde vaya a realizarse.
-
4. Existen numerosas estrategias de financiación para la investigación:
- Convocatorias de ayudas de entidades públicas y privadas.
- Becas Amancio Ortega.
- Donaciones o patrocinios familiares.
-
5. Un buen sistema de planificación del tiempo nos debe permitir alcanzar los objetivos propuestos y debe incluir todos los procesos necesarios para completar el proyecto dentro del plazo requerido:
- Sin embargo, el orden es indiferente, mientras se identifiquen las acciones que tienen que realizarse.
- Es necesario organizarse y evitar la procrastinación, en lo cual pueden ayudar muchas aplicaciones disponibles de forma gratuita.
- Tener presente que eficiencia y perfeccionismo van de la mano, de modo que la productividad aumentará cuando este lo haga.
Autores










Calleja Hernández










Los coordinadores

José Manuel
Martínez Sesmero
Director de Investigación
e Innovación de
la Sociedad Española de
Farmacia Hospitalaria
Doctor en Farmacia
Facultativo Especialista de Área de Farmacia Hospitalaria
Jefe del Servicio de Farmacia Hospitalaria.
Hospital Clínico San Carlos. Madrid

Miguel Ángel
Calleja Hernández
Presidente de la
Sociedad Española
de Farmacia Hospitalaria
Doctor en Farmacia
Farmacéutico Especialista de Área de Farmacia Hospitalaria
Jefe del Servicio
de Farmacia Hospitalaria
Hospital Universitario Virgen Macarena de Sevilla. Servicio Andaluz de Salud
José Manuel
Martinez Sesmero
Director de Investigación e Innovación de la Sociedad Española de Farmacia Hospitalaria
Doctor en Farmacia
Facultativo Especialista de Área de Farmacia Hospitalaria
Jefe del Servicio de Farmacia Hospitalaria. Hospital Clínico San Carlos. Madrid
Conoce a José Manuel
Videos técnicos
Miguel Ángel
Calleja Hernández
Presidente de la Sociedad Española de Farmacia Hospitalaria
Doctor en Farmacia
Farmacéutico Especialista de Área de Farmacia Hospitalaria
Jefe del Servicio de
Farmacia Hospitalaria
Hospital Universitario Virgen Macarena de Sevilla. Servicio Andaluz de Salud
Conoce a Miguel Ángel
Videos técnicos
[1]
Identificación, formulación
y análisis de las preguntas
de investigación
Los autores

Ana de Lorenzo Pinto
Doctora en Farmacia
Facultativo Especialista de Área
de Farmacia Hospitalaria
Board Certified
Pharmacotherapy Specialist
Servicio de Farmacia.
Hospital General
Universitario Gregorio Marañón. Madrid

Raquel García Sánchez
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital General
Universitario Gregorio Marañón. Madrid
Ana de Lorenzo Pinto
Doctora en Farmacia
Facultativo Especialista de Área
de Farmacia Hospitalaria
Board Certified
Pharmacotherapy Specialist
Servicio de Farmacia. Hospital General
Universitario Gregorio Marañón. Madrid
[1]
Identificación, formulación
y análisis de las preguntas
de investigación
Conoce a Ana
Videos técnicos relacionados con el capítulo
Raquel García Sánchez
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia. Hospital General
Universitario Gregorio Marañón. Madrid
[1]
Identificación, formulación
y análisis de las preguntas
de investigación
Conoce a Raquel
Audios relacionados con el capítulo
[2] Selección de las estrategias y metodologías de investigación óptimas
Los autores

Javier Sánchez-Rubio Ferrández
Doctor en Farmacia
Farmacéutico Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid

Rocío Vázquez Sánchez
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid
Javier Sánchez-Rubio Ferrández
Doctor en Farmacia Farmacéutico Especialista de Área de Farmacia Hospitalaria Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid
[2] Selección de las estrategias y metodologías de investigación óptimas
Conoce a Javier
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
Rocío Vázquez Sánchez
Facultativo Especialista de Área de Farmacia Hospitalaria Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid
[2] Selección de las estrategias y metodologías de investigación óptimas
Conoce a Rocío
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
[3]
Investigación y evaluación
de resultados en salud
(datos de vida real)
Los autores

María Jesús Lamas Díaz
Doctora en Farmacia
Facultativo Especialista de
Área de Farmacia Hospitalaria
Jefa del Servicio
de Farmacia Hospitalaria.
Hospital Clínico Universitario Complexo Hospitalario de
Santiago de Compostela

Irene Zarra Ferro
Facultativo Especialista de Área
de Farmacia Hospitalaria
Jefa de Sección del
Servicio de Farmacia.
Hospital Clínico Universitario Complexo Hospitalario de
Santiago de Compostela
Irene Zarra Ferro
Facultativo Especialista de Área
de Farmacia Hospitalaria
Jefa de Sección del Servicio
de Farmacia.
Hospital Clínico Universitario
Complexo Hospitalario
de Santiago de Compostela
[3]
Investigación y evaluación
de resultados en salud
(datos de vida real)
Conoce a Irene
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
[4] Utilización de datos referidos por los pacientes, un reto para la investigación sanitaria
Los autores

Ramón Morillo
Verdugo
Facultativo Especialista de Área
de Farmacia Hospitalaria.
Servicio de Farmacia Hospitalaria.
Hospital Universitario de Valme. Sevilla

María de las Aguas
Robustillo Cortés
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia Hospitalaria.
Hospital Universitario de Valme. Sevilla
Ramón Morillo Verdugo
Facultativo Especialista de Área de Farmacia Hospitalaria. Servicio de Farmacia Hospitalaria.
Hospital Universitario de Valme. Sevilla
[4] Utilización de datos referidos por los pacientes, un reto para la investigación sanitaria
Conoce a Ramón
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
María de las Aguas Robustillo Cortés
Facultativo Especialista de Área de Farmacia Hospitalaria Servicio de Farmacia Hospitalaria.
Hospital Universitario de Valme. Sevilla
[4] Utilización de datos referidos por los pacientes, un reto para la investigación sanitaria
Conoce a María de las Aguas
Audios relacionados con el capítulo
[5] Sesgos en las observaciones clínicas
Los autores

Francisco Javier Carrera
Doctor en Farmacia
Farmacéutico Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Dr. Moliner. Valencia

Piedad López Sánchez
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia. Hospital General de Tomelloso (Ciudad Real)
Francisco Javier Carrera
Doctor en Farmacia
Farmacéutico Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Dr. Moliner. Valencia
[5]
Sesgos en las observaciones clínicas
Conoce a Francisco Javier
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
Piedad López Sánchez
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia. Hospital General de Tomelloso (Ciudad Real)
[5]
Sesgos en las observaciones clínicas
Conoce a Piedad
Audios relacionados con el capítulo
[6]
Legislación y bioética aplicadas al campo
de la investigación e innovación clínica
Los autores

Ángela Gil Martín
Facultativo Especialista de Área
de Farmacia Hospitalaria
Subdirección General de Farmacia
y Productos Sanitarios.
Comunidad de Madrid

Eva Negro Vega
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid
Ángela Gil Martín
Facultativo Especialista de Área
de Farmacia Hospitalaria
Subdirección General de Farmacia
y Productos Sanitarios.
Comunidad de Madrid
[6]
Legislación y bioética aplicadas al campo
de la investigación e innovación clínica
Conoce a Ángela
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
Eva Negro Vega
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitario de Getafe. Madrid
[6]
Legislación y bioética aplicadas al campo
de la investigación e innovación clínica
Conoce a Eva
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
[7]
Innovación abierta en salud
Los autores

Miguel Ángel
Máñez Ortiz
Gestor Sanitario
Dirección General de
Recursos Humanos.
Servicio Madrileño de Salud

Juan Alfredo
Montero Delgado
Facultativo Especialista de Área
de Farmacia Hospitalaria.
Servicio de Farmacia Hospitalaria.
Hospital Universitario Nuestra Señora de Candelaria.
Santa Cruz de Tenerife.
Miguel Ángel Máñez Ortiz
Gestor Sanitario Dirección General de Recursos Humanos.
Servicio Madrileño de Salud
[7]
Innovación abierta en salud
Conoce a Miguel Ángel
Videos técnicos relacionados con el capítulo
Juan Alfredo
Montero Delgado
Facultativo Especialista de Área de Farmacia Hospitalaria. Servicio de Farmacia Hospitalaria.
Hospital Universitario
Nuestra Señora de Candelaria.
Santa Cruz de Tenerife.
[7]
Innovación abierta en salud
Conoce a Juan Alfredo
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
[8] Big data y su utilidad en investigación e innovación sanitaria
Los autores

Ignacio Hernández Medrano
Doctor en Medicina
Facultativo Especialista de Área
de Neurología. Servicio de Neurología.
Hospital Universitario Ramón y Cajal. Madrid
Fundador de Savana y Mendelian

Sergio Plata Paniagua
Facultativo Especialista de Área de Farmacia Hospitalaria
Servicio de Farmacia. Gerencia de Atención
Integrada de Albacete
Ignacio Hernández Medrano
Doctor en Medicina Facultativo Especialista de Área de Neurología.
Servicio de Neurología.
Hospital Universitario Ramón y Cajal. Madrid Fundador de Savana y Mendelian
[8]
Big data y su utilidad
en investigación
e innovación sanitaria
Conoce a Ignacio
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
Sergio Plata Paniagua
Facultativo Especialista de Área de Farmacia Hospitalaria
Servicio de Farmacia. Gerencia de Atención Integrada de Albacete
Coautor de Stop Errores de Medicación
[8]
Big data y su utilidad
en investigación
e innovación sanitaria
Conoce a Sergio
Videos técnicos relacionados con el capítulo
Audios relacionados con el capítulo
[9]
Itinerario para el desarrollo e implementación
de un proyecto de investigación
Los autores

Virginia Bosó Ribelles
Doctora en Farmacia
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia. Hospital Universitari i Politècnic La Fe. Valencia

Ana García Robles
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitari
i Politècnic La Fe. Valencia
Virginia Bosó Ribelles
Doctora en Farmacia
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia. Hospital Universitari i Politècnic La Fe. Valencia
[9]
Itinerario para el desarrollo e implementación
de un proyecto de investigación
Conoce a Virginia
Audios relacionados con el capítulo
Ana García Robles
Facultativo Especialista de Área
de Farmacia Hospitalaria
Servicio de Farmacia.
Hospital Universitari i
Politècnic La Fe. Valencia
[9]
Itinerario para el desarrollo e implementación
de un proyecto de investigación
Conoce a Ana
Audios relacionados con el capítulo

